
| Mg | MgCl2 | Ti | |
| �۵�/�� | 648.0 | 714 | 1667 |
| �е�/�� | 1090 | 1412 | 3287 |
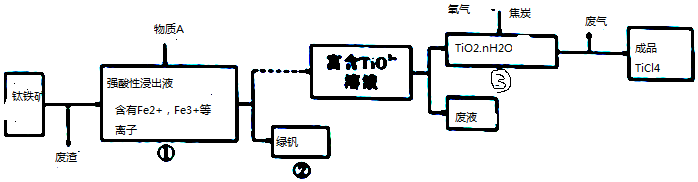
���� ����������������ǿ������Һ�к���Fe3+��Fe2+�����ӣ�����Һ�м���A�ܵõ��̷���˵��A��Fe3+��Ӧ����Fe2+����A����Ӧ�þ��л�ԭ���Ҳ��������µ����ʣ���AΪFe����Һ�к���TiO2+������TiO2������̿�������ڸ����·�Ӧ����TiCl4��ͬʱ����CO���÷�Ӧ�Ļ�ѧ����ʽTiO2+2C+Cl2$\frac{\underline{\;����\;}}{\;}$TiCl4+2CO��
��1��FeTiO3�У�O��FeԪ�ػ��ϼ۷ֱ�Ϊ-2��+2�ۣ����ݻ������и�Ԫ�ػ��ϼ۵Ĵ�����Ϊ0ȷ��TiԪ�صĻ��ϼۣ�
��2�������м��������A�ܻ�ԭ�������Ҳ��������µ����ʣ�
��3�����е��̷������ػ�ɫ�������ӳʻ�ɫ��Fe3+�ܺ�KSCN��Һ��Ӧ����������ʹ��Һ��Ѫ��ɫ��
��4��TiO2������̿�������ڸ����·�Ӧ����TiCl4��ͬʱ����CO��
��5���ý���Mg��ԭ��ƷTiO4�õ�Mg��MgCl2��Ti�Ļ�������������Ʊ�Ti�������¶�Ӧ�ø���Mg��MgCl2�ķе㣻
��6��������ɫ��ѧ�������Ҫ�ۺ����ã�
��7������Fe2+��Fe3+��Һ��������KOH����֬���ڸ���ײ���µõ����������KxFeO2��
����x=l��������������KFeO2��Һ������KI��Һ��Ӧ����I2��Fe 2+��ˮ��FeԪ�ػ��ϼ���+3�۱�Ϊ+2�ۡ�IԪ�ػ��ϼ���-1�۱�Ϊ0�ۣ�����ת�Ƶ����غ���ƽ����ʽ��
�ڴ��������KxFeO2������Ͽ�����ΪaK2O•bFeO•cFe2O3����x=1.3������ԭ���غ����b��c��
��� �⣺����������������ǿ������Һ�к���Fe3+��Fe2+�����ӣ�����Һ�м���A�ܵõ��̷���˵��A��Fe3+��Ӧ����Fe2+����A����Ӧ�þ��л�ԭ���Ҳ��������µ����ʣ���AΪFe����Һ�к���TiO2+������TiO2������̿�������ڸ����·�Ӧ����TiCl4��ͬʱ����CO���÷�Ӧ�Ļ�ѧ����ʽTiO2+2C+Cl2$\frac{\underline{\;����\;}}{\;}$TiCl4+2CO��
��1��FeTiO3�У�O��FeԪ�ػ��ϼ۷ֱ�Ϊ-2��+2�ۣ����ݻ������и�Ԫ�ػ��ϼ۵Ĵ�����Ϊ0ȷ��TiԪ�صĻ��ϼ�Ϊ0-��-2����3-��+2��=+4��
�ʴ�Ϊ��+4��
��2�������м��������A�ܻ�ԭ�������Ҳ��������µ����ʣ���AΪFe���ʴ�Ϊ��Fe��
��3�����е��̷������ػ�ɫ�������ӳʻ�ɫ��������Һ�п��ܺ��������ӣ�Fe3+�ܺ�KSCN��Һ��Ӧ����������ʹ��Һ��Ѫ��ɫ������鷽��Ϊ��ȡ��������ˮ������Һ�м���KSCN��Һ�������Һ��ΪѪ��ɫ��֤������Fe3+��
�ʴ�Ϊ��Fe3+��ȡ��������ˮ������Һ�м���KSCN��Һ�������Һ��ΪѪ��ɫ��֤������Fe3+��
��4��TiO2������̿�������ڸ����·�Ӧ����TiCl4��ͬʱ����CO����Ӧ����ʽΪTiO2+2C+Cl2$\frac{\underline{\;����\;}}{\;}$TiCl4+2CO��
�ʴ�Ϊ��TiO2+2C+Cl2$\frac{\underline{\;����\;}}{\;}$TiCl4+2CO��
��5���ý���Mg��ԭ��ƷTiO4�õ�Mg��MgCl2��Ti�Ļ�������������Ʊ�Ti�������¶�Ӧ�ø���Mg��MgCl2�ķе㣬ʹMg��MgCl2��ת��Ϊ��������ȥ�������¶ȸ���1412�棬
�ʴ�Ϊ��1412��
��6��������ɫ��ѧ�������Ҫ�ۺ����ã�������ͼ������û�д�����
�ʴ�Ϊ������û�д�����
��7������Fe2+��Fe3+��Һ��������KOH����֬���ڸ���ײ���µõ����������KxFeO2��
����x=l��������������KFeO2��Һ������KI��Һ��Ӧ����I2��Fe 2+��ˮ��FeԪ�ػ��ϼ���+3�۱�Ϊ+2�ۡ�IԪ�ػ��ϼ���-1�۱�Ϊ0�ۣ�ת�Ƶ�����Ϊ2������ת�Ƶ����غ���ƽ����ʽΪ8H++2FeO2-+2I-=2Fe2++I2+4H2O��
�ʴ�Ϊ��8H++2FeO2-+2I-=2Fe2++I2+4H2O��
�ڴ��������KxFeO2������Ͽ�����ΪaK2O•bFeO•cFe2O3����x=1.3������Kԭ�Ӹ�����ȵ�
$\frac{1.3}{2}$K2O•bFeO•cFe2O3��
����Fe��Oԭ�Ӹ�����ȵ�$\left\{\begin{array}{l}{b+2c=1}\\{0.65+b+3c=2}\end{array}\right.$
���$\left\{\begin{array}{l}{b=0.3}\\{c=0.35}\end{array}\right.$��
��b��c=0.3��0.35=6��7��
�ʴ�Ϊ��6��7��
���� ���⿼�����ʷ�����ᴿ��Ϊ��Ƶ���㣬�漰���㡢�����Ʊ������ʷ����ᴿ�����Ӽ����֪ʶ�㣬���ؿ���ѧ���ۺϷ����жϡ�֪ʶ�ۺ����ü�������������ȷ�������ʡ�����֮���ת������ѧ��Ӧԭ�����ǽⱾ��ؼ���ע�������Ӽ��鷽����ʵ�������״��������Ӽ����л�ѧ�������ȷ���ã�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Ӧ���Ȼ������Ƴ�����ⷴӦ�Ƶ⻯�� | |
| B�� | CO2ͨ�뵽Ư����Һ�з���CO2+Ca��ClO��2+H2O=CaCO3��+2HClO���Ƴ�SO2ͨ�뵽Ư����Һ�з���SO2+Ca��ClO��2+H2O=CaSO3��+2HClO | |
| C�� | Na2O2��CO2��Ӧ����Na2CO3��O2���Ƴ�Na2O2��SO2��Ӧ������Na2SO3��O2 | |
| D�� | ���ÿ����Ե�������Һ�백ˮ��Ӧ��Al��OH��3���Ƴ������Ե�������Һ�백ˮ��Ӧ��Fe��OH��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
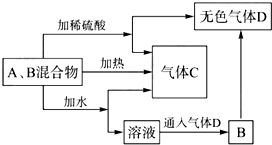 ��A��B���ֳ������������ɫ��Ӧ���ʻ�ɫ��C��һ�ֵ������壬�ת����ϵ��ͼ��ʾ���������ʾ�����ȥ�����ش��������⣺
��A��B���ֳ������������ɫ��Ӧ���ʻ�ɫ��C��һ�ֵ������壬�ת����ϵ��ͼ��ʾ���������ʾ�����ȥ�����ش��������⣺
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
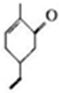 �������й�M��˵����ȷ���ǣ�������
�������й�M��˵����ȷ���ǣ�������| A�� | ���Է���������Ӧ | B�� | ����ʽC9H10O | ||
| C�� | ����������ԭ�Ӷ�����ͬһƽ���� | D�� | ����ʹ������Ȼ�̼��Һ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
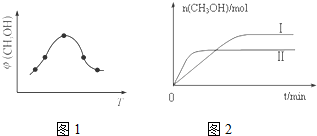
| �� �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO2 3molH2 | a molCO2��b molH2��c molCH3OH��g����c molH2O��g�� ��a��b��c��������0�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 6.02��1023 | B�� | 6.02��1022 | C�� | 6.02��1021 | D�� | 6.02��1020 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Һ̬�廯�� | B�� | ���� | C�� | �� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com