
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是( )
A. 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成Cl2分子数为0. 3 NA
B. 80gSO3在标准状况下所占体积约为22.4L
C. 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,转移的电子的数目为NA
D. 5.4g铝粉与足量的氢氧化钠溶液充分反应生成H2分子数为0. 3 NA
【答案】D
【解析】A、MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,所以0.1L×12mol/L=1.2mol HCl如果完全反应生成Cl2 0.3mol,但是由于反应过程中随着浓盐酸浓度不断降低,反应在HCl没有完全消耗时就不再进行,所以得到的Cl2也就小于0.3mol,HCl分子数小于0.3NA,A错误。B、SO3在标准状态下不是气体,所以本题体积无法计算,B错误。C、因为I-还原性大于Fe2+,所以Fe2+被氧化时,溶液中的I-已经完全被氧化。溶液中有1mol Fe 2+被氧化,则溶液中Fe2+≥1mol,则n(I-)≥2mol,反应过程中转移的电子数等于1×1mol+1×n(I-)≥3mol,C错误。D、足量的NaOH能够将铝粉完全反应,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
MnCl2+Cl2↑+2H2O,所以0.1L×12mol/L=1.2mol HCl如果完全反应生成Cl2 0.3mol,但是由于反应过程中随着浓盐酸浓度不断降低,反应在HCl没有完全消耗时就不再进行,所以得到的Cl2也就小于0.3mol,HCl分子数小于0.3NA,A错误。B、SO3在标准状态下不是气体,所以本题体积无法计算,B错误。C、因为I-还原性大于Fe2+,所以Fe2+被氧化时,溶液中的I-已经完全被氧化。溶液中有1mol Fe 2+被氧化,则溶液中Fe2+≥1mol,则n(I-)≥2mol,反应过程中转移的电子数等于1×1mol+1×n(I-)≥3mol,C错误。D、足量的NaOH能够将铝粉完全反应,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,![]() ,所以生成H2分子数为0.3NA,D正确。正确答案D。
,所以生成H2分子数为0.3NA,D正确。正确答案D。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】含铬化合物的废水有毒,特别是Cr(Ⅵ)有致癌作用,对农作物及微生物的毒害很大.目前处理的方法较多,还原沉淀法是较为广泛的处理含铬废水的方法,流程如图: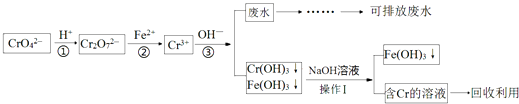
(1)步骤①中存在平衡:2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O该反应的平衡常数表达式K=;碱性溶液中Cr(Ⅵ)离子的颜色呈 . (填“黄色”或“橙色”)
(2)上述操作Ⅰ的名称为 , 以下物质可用于代替步骤②中的Fe2+的是
A.KMnO4(H+) B.HNO3 C.Na2SO3
(3)步骤③中出水总铬与溶液的pH关系如图,下列说法不正确的是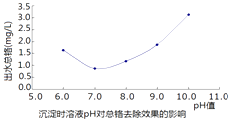
A.为有效除去Cr3+ , 加入的碱越多越好
B.Cr(OH)3可溶于强碱
C.要除去Cr3+ , 调节pH值最好为7左右
(4)已知Ksp[Cr(OH)3]=1.1×10﹣32 , 按《污水综合排放标准》,水质中总铬的浓度应小于3×10﹣5molL﹣1 , 当步骤③调节pH=6时,该处理后的污水是否达到排放标准?(填“是”或“否”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要作用.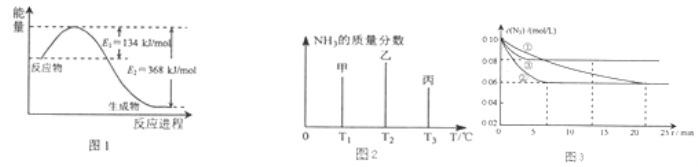
(1)图1是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 .
(2)在固定容积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 用一定物质的量的N2和H2合成NH3 , 三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如图2所示:
此时甲、乙、丙三个容器中一定达到化学平衡状态的是容器,都达到平衡状态时,NH3的质量分数最高的是容器(填甲、乙、丙).
图3是实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.10mol/L,c(H2)=0.26mol/L进行反应时,N2的浓度随时间的变化如图①、②、③曲线所示.
Ⅰ该反应实验②平衡时H2的转化率为 .
Ⅱ据图3所示,②装置中有一个条件与①不同,请指出②相对①改变的条件 .
Ⅲ计算实验③的平衡常数为 .
(3)铜与一定浓度硝酸反应时方程式可表示为:Cu+HNO3一Cu(NO3)2+NO+NO2+H2O(方程式未配平).3.2g Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下NO体积为 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应NO2(g)+CO(g)=NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是

A. 图中A→B的过程为放热过程
B. 1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C. 该反应为氧化还原反应
D. 1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素的简单离子都含有10个电子,且对应元素化合价与原子序数的关系如图所示。

(1)将A、E两种元素的元素符号填入下表中正确的位置上。________
族序数 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | ||||||||
三 | ||||||||
(2)A、B、C、D、E、F六种元素中非金属性最强的是____________(填元素符号),B、D两元素可以组成原子个数比为1:1的离子化合物,写出该离子化合物的电子式:______,A、B两元素对应的气态氢化物的稳定性强弱关系是________________(用化学式表示)。
(3)写出D、F两元素的最高价氧化物对应的水化物反应的离子方程式:________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型夹心层石墨烯锂硫二次电池的工作原理可表示为16Li+xS8 ![]() 8Li2Sx,其放电时的工作原理如图所示,下列有关该电池的说法正确的是( )
8Li2Sx,其放电时的工作原理如图所示,下列有关该电池的说法正确的是( ) 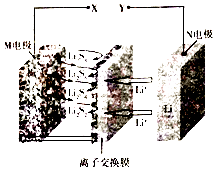
A.电池充电时X为电源负极
B.放电时,正极上可发生反应:2Li++Li2S4+2e﹣=2Li2S2
C.充电时,没生成1molS8转移0.2mol电子
D.离子交换膜只能通过阳离子,并防止电子通过
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com