
关于化学键的下列表述中,正确的是()
A. 共价化合物可能含有离子键
B. 离子化合物中可能含有共价键
C. 离子化合物中只含有离子键
D. 硫酸中含有离子键
考点: 化学键.
专题: 化学键与晶体结构.
分析: A.共价化合物只含共价键,不含离子键;
B.离子化合物一定含有离子键,可能含有共价键;
C.有些离子化合物中含有离子键,如碱、含氧酸盐、过氧化物等;
D.硫酸为共价化合物,只含有共价键.
解答: 解:A.共价化合物只含共价键,组成微粒为分子,不存在离子之间的静电作用,不含离子键,故A错误;
B.离子化合物一定含有离子键,可能含有共价键,如NaOH中O﹣H键为共价键,故B正确;
C.有些离子化合物中含有离子键,如碱(NaOH)、含氧酸盐(NaClO)、过氧化物(Na2O2)等,故C错误;
D.硫酸为共价化合物,只含有共价键,不含离子键,故D错误.
故选B.
点评: 本题考查化学键知识,题目难度不大,本题注意离子键与共价键的区别,答题中要善于找出含有共价键或离子键的例子.


科目:高中化学 来源: 题型:
历史上最早应用的还原性染料是靛蓝,其结构简式如下,下列关于靛蓝的叙述中错误的是( )
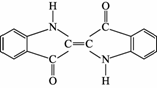
A.靛蓝由碳、氢、氧、氮4种元素组成
B.该物质是高分子化合物
C.它的分子式是C16H10N2O2
D.它是不饱和有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
原子轨道的杂化不但出现在分子中,原子团中同样存在原子轨道的杂化。在
SO42-中S原子的杂化方式为 ( )。
A.sp B.sp2 C.sp3 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
硅单质及其化合物应用很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下 :




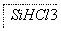

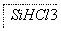


①写出由纯SiHCl3制备高纯硅的化学反应方程式____________________。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、
HCl和另一种物质,写出配平的化学反应方程式____________________;H2
还原SiHCl3过程中若混有O2,可能引起的后果是____________________。
(2)下列有关硅材料的说法正确的是 ( )。
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入盐酸,
振荡。写出实验现象并给予解释(用化学方程式说
明)____________________________________________________________。
(4)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,
这种材料是________(填字母)。
A.高温结构陶瓷 B.生物陶瓷 C.导电陶瓷
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来发现铊(Tl)是高温超导材料的成分之一,已知铊与铝是同族元素,关于铊的下列性质判断中,可能错误的是()
A. 是银白色、质软的金属 B. 能形成+3价的化合物
C. Tl(OH)3是两性氢氧化物 D. 能与硝酸反应生成硝酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、R、Q是短周期元素,R、Q和X、Y分别处于同一周期,R、Y处于同一主族,Q2﹣和X2+具有相同的电子层结构,其中Q是地壳中含量最高的元素,R最外层电子数是次外层的2倍.下列说法正确的是()
A. 离子半径:Q2﹣>X2+
B. 原子序数:Y>R>Q
C. 简单气态氢化物的稳定性:R>Q>Y
D. 原子最外层电子数:X>Y>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是()
A. CH3Cl不存在同分异构体 B. CH2Cl2不存在同分异构体
C. CHCl3不存在同分异构体 D. CCl4不存在同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关沉淀溶解平衡的说法中,正确的是( )
|
| A. | Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度 |
|
| B. | 在氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp增大 |
|
| C. | 在碳酸钙的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动 |
|
| D. | 向氯化银沉淀溶解平衡体系中加人碘化钾固体,氯化银沉淀可转化为碘化银沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大.
(1)已知25℃时:SO2(g)+2CO(g)═2C02(g)+ Sx(s)△H=a kJ•mol﹣1;
Sx(s)△H=a kJ•mol﹣1;
2COS(g)+SO2(g)═2CO2(g)+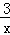 Sx(s)△H=b kJ•mol﹣1.则CO与Sx生成COS反应的热化学方程式是 .
Sx(s)△H=b kJ•mol﹣1.则CO与Sx生成COS反应的热化学方程式是 .
(2)有人设想按如图甲所示装置用废气中的SO2生产硫酸.写出SO2电极的电极反应式 .
(3)提高反应2SO2(g)+O2⇌2SO3(g)△H<0中SO2的转化率是控制SO2排放的关键措施之一.某课外活动小组进行了如下探究:
①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5min后反应达到平衡,二氧化硫的转化率为
50%,前5min内SO2的平均反应速率为 .
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是 (填序号).
a温度和容器体积不变,充入1.0molHe (g)
b温度和容器体积不变,充入2molSO2和lmolO2
c温度和容器体积不变,充入1.0molSO2
d在其他条件不变时,减小容器的容积
③在其他条件不变的情况下,探究起始时氧气物质的量对2SO2(g)+O2(g)⇌2SO3(g)反应的影响,实验结果如
图乙所示.(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的
是 ,温度T1 T2(填“>”“<”或“一”).

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com