
分析 根据PV=nRT可以计算出生成氢气的物质的量,由此推出金属的物质的量,依据M=$\frac{m}{n}$计算出金属的摩尔质量,从而得到金属的相对原子质量.
解答 解:已知收集气体的总压P=100.0kPa,水的饱和蒸气的分压P(H2O)=2.1kPa,
则氢气的分压P(H2)=100kPa-2.1kPa=97.9kPa,
P(H2)V=n(H2)RT
97.9×103Pa×38.5×10-6m3=n(H2)×8.314J/(mol•K)×291K
n(H2)=0.00156mol
由题意可知n(金属)=n(H2)=0.00156mol
M(金属)=$\frac{m}{n}$=$\frac{0.102g}{0.00156mol}$=65g/mol
答:此金属的相对原子质量为65.
点评 本题主要考查了PV=nRT公式的应用、摩尔质量的计算等,主要要注意分压的计算,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 苯在催化剂作用下能与液溴发生取代反应 | |
| B. | 在一定条件下苯能与氯气发生加成反应 | |
| C. | 在苯中加入酸性高锰酸钾溶液,振荡并静置后下层液体为紫红色 | |
| D. | 在苯中加入溴水,振荡并静置后下层液体为橙色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
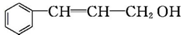 乙:
乙: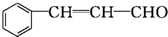
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀硫酸中水解 |
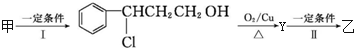
 (注明反应条件).
(注明反应条件).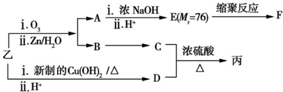
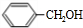 +
+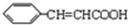 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ 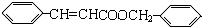 +H2O
+H2O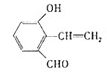 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过电解熔融CD3可以制备C单质 | |
| B. | A和B可以形成BA3、B2A4等酸性化合物 | |
| C. | C的氢氧化物可以溶于B或D的最高价氧化物的水化物 | |
| D. | BA4BO3中只存在非金属元素,只存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是光导纤维的主要成分 | |
| B. | 氢氟酸具有强酸性,可用于蚀刻玻璃 | |
| C. | 碳纤维是一种新型有机高分子材料 | |
| D. | 硅胶可做药品和食品的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | ZnO | C. | Na2CO3 | D. | Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
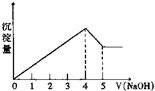 有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )
有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )| A. | 2:1 | B. | 4:1 | C. | 1:2 | D. | 1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com