
| 阳离子 | Ag+ Ba 2+ Al3+ |
| 阴离子 | OH-Cl-SO42- |


科目:高中化学 来源: 题型:
| A、烷烃的熔、沸点随着相对分子质量的增大而升高 |
| B、凡是分子组成相差一个或若干个“CH2”原子团的物质,彼此一定是同系物 |
| C、各组成元素的质量分数相同且相对分子质量也相同的不同有机物一定互为同分异构体 |
| D、同分异构体间有相似的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 和
和 的物质互为同分异构体,我们称之为顺反异构.则分子式为C5H10的有机物,属于烯烃的同分异构体的数目为
的物质互为同分异构体,我们称之为顺反异构.则分子式为C5H10的有机物,属于烯烃的同分异构体的数目为 的二氯代物有
的二氯代物有 的二氯代物有
的二氯代物有查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
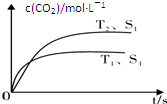
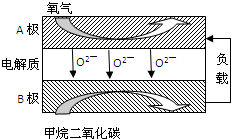
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com