
| A. | 氧化铁中滴加稀盐酸溶解:FeO+2H+═Fe2++H2O | |
| B. | 用稀硫酸、双氧水除去FeCl3溶液中的FeCl2杂质:Fe2++2H++H2O2═Fe3++2H2O | |
| C. | 硫酸铝溶液中滴加氨水制取氢氧化铝:Al3++3OH-═Al(OH)3↓ | |
| D. | 向NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+2OH-+Ca2+═2H2O+CaCO3↓+CO32- |
分析 A.氧化铁为三氧化二铁,在离子反应中保留化学式;
B.电子、电荷不守恒;
C.一水合氨在离子反应中保留化学式;
D.少量澄清石灰水完全反应,生成碳酸钙、碳酸钠、水.
解答 解:A.氧化铁中滴加稀盐酸溶解的离子反应为Fe2O3+6H+═2Fe3++3H2O,故A错误;
B.用稀硫酸、双氧水除去FeCl3溶液中的FeCl2杂质的离子反应为2Fe2++2H++H2O2═2Fe3++2H2O,故B错误;
C.硫酸铝溶液中滴加氨水制取氢氧化铝的离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C错误;
D.向NaHCO3溶液中滴加少量澄清石灰水,离子反应为2HCO3-+2OH-+Ca2+═2H2O+CaCO3↓+CO32-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
| c(CO) | c(H2) | c(CH3OH) | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
 VO2++V3++H2O,试推写出放电时正极的电极反应式VO2++2H++e-=VO2++H2O.
VO2++V3++H2O,试推写出放电时正极的电极反应式VO2++2H++e-=VO2++H2O. Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )| A. | c和w都不同 | B. | c和w都相同 | C. | c相同,w不同 | D. | w相同,c不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用H2O2制氧气 | B. | 工业上用氨气制硝酸 | ||
| C. | 实验室用浓HNO3制NO2气体 | D. | 实验室用氯化铵制氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油和植物油都是混合物,且属于不同类的有机物 | |
| B. | 甲酸的性质与乙酸类似,都不能被酸性高锰酸钾溶液氧化 | |
| C. | 用酸性K2Cr2O7 溶液鉴别乙醇与乙醛溶液 | |
| D. | 纤维素、蔗糖、葡萄糖和淀粉酶在一定条件下都可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 推论 |
| A | 含Ag+离子的溶液中滴加稀盐酸会产生白色沉淀 | 滴加稀盐酸产生白色沉淀的溶液中一定含有Ag+离子 |
| B | 硫酸铝溶液中滴加过量氨水制取氢氧化铝沉淀 | 硫酸铝溶液中滴加过量NaOH溶液最终得不到氢氧化铝沉淀 |
| C | Fe(OH)3固体中滴加稀盐酸生成氯化铁和水 | Fe(OH)3固体中滴加HI生成碘化铁和水 |
| D | 铜片不溶于稀硫酸 | 铜片也不溶于稀硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
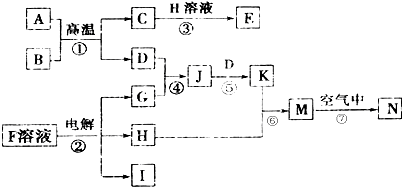
 ,N的化学式为Fe(OH)3.
,N的化学式为Fe(OH)3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 推论 |
| A | 含Ag+离子的溶液中滴加氯化钡溶液会产生白色沉淀 | 滴加氯化钡溶液产生白色沉淀的溶液中不一定含有Ag+离子 |
| B | 常温下铜与浓硝酸可以制取NO2 | 常温下铁与浓硝酸也可以制取NO2 |
| C | Fe(OH)3固体中滴加稀盐酸生成氯化铁和水 | Fe(OH)3固体中滴加氢碘酸生成碘化铁和水 |
| D | 铜片不溶于稀硫酸 | 铜片也不溶于稀硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com