
| 选项 | 氯水滴入下列溶液中 | 实验现象 | 结论 |
| A | 滴有KSCN的FeCl2溶液 | 变红 | Cl2具有还原性 |
| B | KI-淀粉溶液 | 变蓝色 | Cl2具有氧化性 |
| C | 紫色石蕊溶液 | 先变红后褪色 | Cl2具有漂白性 |
| D | 滴有酚酞的NaOH溶液 | 褪色 | Cl2具有酸性 |
| A.A | B.B | C.C | D.D |
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 9(b-a) |
| a |
| 9(b-a) |
| a |
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
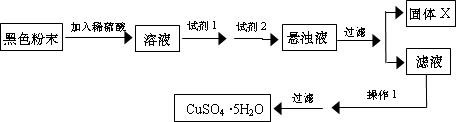
查看答案和解析>>
科目:高中化学 来源: 题型:
(13分)根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、检验装置气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是___________________________。装置A中试剂是________________。
③能说明碳的非金属性比硅强的实验现象是________________________________________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是______________________________________。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
|
|
写出其中SO2显示还原性并生成沉淀的离子方程式__________________________________。
④将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入一定量的B气体,实验过程中可得到沉淀的最大质量为1.2g。
试计算:原混合物中KOH的质量为_____________g。生成沉淀质量为最大时,消耗B气体(标准状况下)的体积(V)范围是:_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2012届北京四中高三上学期期中测试化学试卷 题型:实验题
(13分)根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)

(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、检验装置气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是___________________________。装置A中试剂是________________。
③能说明碳的非金属性比硅强的实验现象是________________________________________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是______________________________________。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | | |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京四中高三上学期期中测试化学试卷 题型:实验题
(13分)根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)

(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、检验装置气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是___________________________。装置A中试剂是________________。
③能说明碳的非金属性比硅强的实验现象是________________________________________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是______________________________________。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
|
滴加的溶液 |
氯水 |
氨水 |
|
沉淀的化学式 |
|
|
写出其中SO2显示还原性并生成沉淀的离子方程式__________________________________。
④将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入一定量的B气体,实验过程中可得到沉淀的最大质量为1.2g。
试计算:原混合物中KOH的质量为_____________g。生成沉淀质量为最大时,消耗B气体(标准状况下)的体积(V)范围是:_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com