
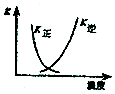
 A.2SO2(g)+O2(g)?2SO3(g)△H<0 |  B.25℃时,用0.1mol/L盐酸滴定20mL0.1mol/LNaOH溶液 |
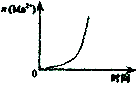 C.酸性KmnO4溶于与过量的H2C2O4溶液混合 |  D.CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0,使用催化剂(a)和未使用催化剂(b) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫与氧气反应,正反应为放热反应,温度升高,平衡逆向进行;
B.酸碱中和的时候pH会突变;
C.酸性KMnO4溶于与过量的H2C2O4溶液混合,该反应为自催化反应,即反应生成的锰离子可以作为催化剂;
D.催化剂能降低反应的活化能,但不改变反应热.
解答 解:A.2SO2(g)+O2(g)?2SO3(g)△H<0,正反应为放热反应,温度升高,V逆>V正,平衡逆向进行,故A正确;
B.用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1NaOH溶液的pH随加入盐酸体积的变化,pH会突变,如图应为: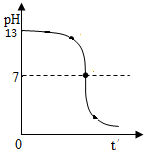 ,故B错误;
,故B错误;
C.KMnO4酸性溶液与H2C2O4(草酸)溶液在酸性环境下会发生氧化还原反应:KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,生成的Mn2+,起催化作用,随着反应的进行,锰离子浓度增大,反应速率增大,故C正确;
D.a降低了活化能,使用了催化剂,故D正确;
故选B.
点评 本题考查图象的有关知识,把物质之间相互作用的实验现象和图中信息结合起来进行分析、判断是解答本题的关键,易错选项是B,注意酸碱中和的时候pH会突变,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH=CH2能发生取代反应,加成反应、氧化反应 | |
| B. | 月桂烯(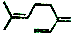 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 甲烷、乙烯、苯和乙醇都能使酸性KMnO4溶液褪色 | |
| D. | 油脂皂化反应得到高级脂肪酸与甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
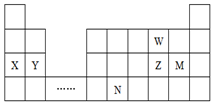
| A. | 原子半径:Y>Z>W,简单离子半径:M->Z2->W2- | |
| B. | 单质的还原性:X>Y,简单氢化物的沸点:Z>W | |
| C. | 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N的单质可作 半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
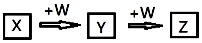 X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如图转化关系(其它产物已略去):下列说法不正确的是( )
X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如图转化关系(其它产物已略去):下列说法不正确的是( )| A. | 若W是强氧化性的单质,则X可能是金属铝 | |
| B. | 若W是氢氧化钠,则X水溶液为酸性 | |
| C. | 若W是单质铁,则Z溶液可能是FeCl2溶液 | |
| D. | 若W是氧气,则X、Z的相对分子质量可能相差48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
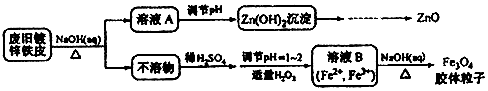
| A. | 用NaOH溶液处理废旧镀锌铁皮的作用是去除油污、溶解镀锌层 | |
| B. | 调节溶液A的pH产生Zn(OH)2沉淀,经抽滤、洗涤、灼烧即可制得ZnO | |
| C. | 由溶液B制得Fe3O4胶体粒子的过程中,须持续通N2,其原因是防止Fe2+被氧化 | |
| D. | Fe3O4胶体粒子能用减压过滤法实现固液分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的最高价氧化物能与水反应生成相应的酸 | |
| B. | 室温下,0.05mol•L-1的M的气态氢化物的水溶液的PH>l | |
| C. | 简单离子半径由大到小的顺序:Y>Z>M | |
| D. | Y、Z元素的单质作电极,在NaOH溶液环境下构成原电池,Z电极上产生大量气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H2>0 | |
| B. | B为H2和O2制备H2O2的催化剂 | |
| C. | 反应①的正反应的活化能大于逆反应的活化能 | |
| D. | H2(g)+O2(g)?H2O2(1)的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| C(NO)/mol•L-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-5 | 1.50×10-3 | 1.5×10-3 |
| C(CO)/mol•L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
| A. | -定温度下,从开始到平衡,该反应的平衡常数逐渐增大 | |
| B. | 前2s内的平均反应速率v(N2)=1.75×10-3 mol•L-1•s-1 | |
| C. | 达到平衡时,CO的转化率为11.11% | |
| D. | 3s时NO和CO的浓度都不再变化,反应停止进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3NA | |
| B. | 1.5 mol Na2O和Na2O2的混合物中离子数目为4.5 NA | |
| C. | 标准状况下,11.2 L HF中含有的分子数为0.5NA | |
| D. | 常温常压下,17 g 羟基含有的电子总数为9 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com