
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。

(1)T的原子结构示意图是________。用化学方程式表示工业上常用于冶炼T单质的原 理是________________________________________ ________________________________。
理是________________________________________ ________________________________。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中的共价键类型是________。
(3)元素的非金属性:Q________W(填“强于”或“弱于”),结合方程式简述其原因是________________。
(4)甲是R的氧化物,通常状况下呈红棕色。现有一试管甲,欲使元素R全部转化为其最高价氧化物对应的水化物,实验步骤:将盛有甲的试管倒扣在水槽中,________________。
解析 观察图中所给元素在周期表中的位置关系可知T位于第三周期,又由于其所处的周期序数与主族序数相等,所以可判断出T是Al。则Q、R、W分别是C、N、S。(1)工业上,电解熔融的氧化铝冶炼铝。(2)S位于第ⅥA族,该族某元素的氢化物中含有18个电子,则该元素是O,氢化物是H2O2,其结构式为H—O—O—H,分子中含有H—O极性键和O—O非极性键。(3)元素的非 金属性越强,其最高价含氧酸的酸性越强。根据CO
金属性越强,其最高价含氧酸的酸性越强。根据CO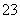 能发生水解反应而SO
能发生水解反应而SO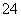 不发生水解反应可知,碳酸是弱酸而硫酸是强酸,从而说明碳的非金属性比硫弱。也可以根据Na2CO3与H2SO4能发生复分解反应来说明。(4)将NO2通入水中,发生反应:3NO2+H2O===2HNO3+NO,生成的NO不溶于水。向其中通入氧气,发生反应:2NO+O2===2NO2。将两个方程式合并可得:4NO2+O2+2H2O===4HNO3。因此,向试管中缓缓通入足量氧气,可使NO2完全转化为硝酸。
不发生水解反应可知,碳酸是弱酸而硫酸是强酸,从而说明碳的非金属性比硫弱。也可以根据Na2CO3与H2SO4能发生复分解反应来说明。(4)将NO2通入水中,发生反应:3NO2+H2O===2HNO3+NO,生成的NO不溶于水。向其中通入氧气,发生反应:2NO+O2===2NO2。将两个方程式合并可得:4NO2+O2+2H2O===4HNO3。因此,向试管中缓缓通入足量氧气,可使NO2完全转化为硝酸。
答案 (1)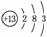 2Al2O3(熔融)
2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
(2)极性键和非极性键
(3)弱于 CO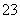 +H2OHCO
+H2OHCO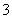 +OH-,碳酸根离子水解,而硫酸根离子不发生水解(合理即可)
+OH-,碳酸根离子水解,而硫酸根离子不发生水解(合理即可)
(4)向试管中缓缓通入足量氧气


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 碳纳米管是由碳原子组成的六角形蜂巢状平面薄膜卷曲而成,具有许多异常的力学、电学和化学性能。下列关于碳纳米管的说法不正确的是( )
碳纳米管是由碳原子组成的六角形蜂巢状平面薄膜卷曲而成,具有许多异常的力学、电学和化学性能。下列关于碳纳米管的说法不正确的是( )
A.碳纳米管属于一种有机合成纤维
B.碳纳米管与金刚石互为同素异形体
C.常温下,碳纳米管具有较好的稳定性
D.碳纳米管比表面积大,可用作新型储氢材料
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,用含 0.2mol NaOH的溶液恰好吸收0.2mol NO2后得1L溶液,反应的化学方程式为:2NO2+2NaOH→NaNO3+NaNO2+H2O.对反应后的溶液,下列说法正确的是(已知:Ka(HNO2)=7.1×10﹣4、Ka(CH3COOH)=1.7×10﹣5)( )
|
| A. | n(NO2﹣)+n(OH﹣)﹣n(H+)=0.1 mol |
|
| B. | 若通入0.01 mol HCl气体,溶液pH大于2(忽略溶液体积的变化) |
|
| C. | 若加入少量CH3COONa固体,溶液的碱性会减弱 |
|
| D. | 此时溶液的pH大于0.1 mol/L的CH3COONa溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.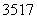 Cl与
Cl与 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
现有原子序数依次相差1,且由小到大排列的A、B、C、D、E五种短周期元素。下列有关这五种元素的叙述正确的是( )
①若A的最高价氧化物对应的水化物是强碱,则E的最高价氧化物对应的水化物是强酸
②若A的单质既能与强酸又能与强碱反应且都放出氢气,则这五种元素在同一周期
③若A的阳离子比E的阴离子少8个电子,则D一定是非金属元素
④若D的最高价氧化物对应的水化物是强酸,则E的单质在常温下为气态
⑤这五种原子的原子半径关系一定为:A>B>C>D>E
A.②③④ B.①②③
C.③④⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能达到实验目的的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
续表
| 选项 | 实验目的 | 实验方案 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与平衡移动无关的是
A.实验室排饱和盐水收集氧气 B.打开汽水瓶后,瓶中马上泛起大量气泡
C.热纯碱溶液去油污能力更强 D.NH4Cl(s) 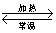 NH3(g)+HCl(g)
NH3(g)+HCl(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)2NH3(g)+
CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是 ( )
| 温度 | 平衡浓度(mol·L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)2C(g)+D(s)反应,
按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:
_______________________________。
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com