
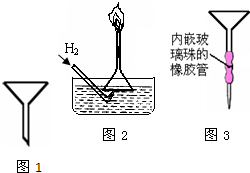
 普通漏斗(见图1)是中学化学实验室常用仪器之一.我们对它的用途并不陌生.
普通漏斗(见图1)是中学化学实验室常用仪器之一.我们对它的用途并不陌生.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
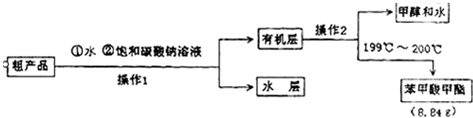
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁、四氧化三铁、冰水混合物 |
| B、金属钙、生石灰、碱石灰 |
| C、水银、空气、干冰 |
| D、二氧化硫、水蒸气、天然气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
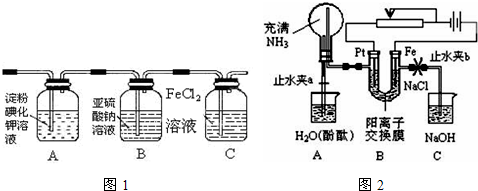
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加 | 若产生白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加 | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中 滴加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
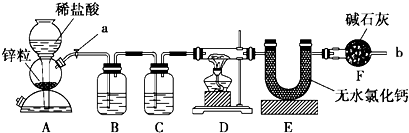
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 浓硝酸与水的体积比 | 实验现象 |
| Ⅰ | 1:1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
| Ⅱ | 1:3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
| Ⅲ | 1:5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
| 影响因素 | 实验步骤 | 实验结论 |
| 金属种类 | 两只烧瓶中各放入5g颗粒大小大致相同的Fe粉、Mg粉,分别加入 | 在该浓度的稀HNO3中,Mg能反应, |
| HNO3浓度 | 两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,分别加入 | 硝酸浓度 |
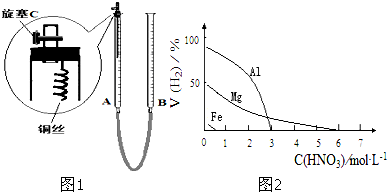
查看答案和解析>>
科目:高中化学 来源: 题型:
A、该反应的化学平衡常数表达式是K=
| ||
| B、此时,B的平衡转化率是35% | ||
| C、增大该体系的压强,平衡向右移动,化学平衡常数 | ||
| D、增加C,B的平衡转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是碱性氧化物 |
| B、可置于呼吸面具中提供O2 |
| C、无须密封保存 |
| D、投入水中会使溶液变红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com