
| A. | CaCl2 | B. | CH3COONa | C. | NH3 | D. | Na2S |
分析 这几种盐在水溶液里完全电离,弱离子在水溶液里水解,多元弱酸根离子分步水解,据此分析解答.
A.氯化钙为强酸强碱盐;B.乙酸钠为弱酸强碱盐;C.氨气溶于水生成弱碱生成一水合氨;D.硫化钠为多元弱酸的正盐.
解答 解:A.CaCl2溶液中所含粒子为Ca2+、Cl-、H2O、H+、OH-,共5种粒子;
B.CH3COONa溶液中,CH3COO-要水解,所含粒子为CH3COO-、Na+、H2O、H+、OH-、CH3COOH,共6种粒子;
C.氨气溶于水生成弱碱生成一水合氨,溶液中含有H+、OH-、NH3•H2O、NH4+、H2O,故5种粒子;
D、Na2S溶液中硫离子分步水解,含有Na+、S2-、HS-、OH-、H+、H2O、H2S,故7种;
上述溶液中含有粒子种类最多的是硫化钠溶液;
故选D.
点评 本题考查了盐类水解,根据盐类水解特点结合溶液中存在的微粒种类分析解答,知道多元弱酸根离子要分步水解,知道多元弱酸和多元弱碱水解的区别,题目难度不大.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:多选题
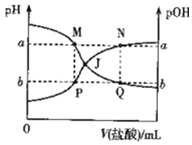
| A. | 曲线PJN表示溶液中pH的变化 | |
| B. | M点水的电离程度比Q点大 | |
| C. | M、P两点的数值之和a+b=14 | |
| D. | pH与pOH交叉点J对应的V(盐酸)=20.00 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(N2)/mol•L-1 | 0.46 | 0.46 | 0.92 |
| c(O2)/mol•L-1 | 0.46 | 0.23 | 0.92 |
| A. | 起始时,反应速率:丙>甲>乙 | B. | 平衡时,c(NO):甲=丙>乙 | ||
| C. | 平衡时,N2的转化率:甲>乙 | D. | 平衡时,甲中c(N2)=0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将KI溶液滴入FeCl3溶液中,加入CCl4,振荡、静置 | 下层溶液显紫色 | 还原性:Fe2+<I- |
| B | 将SO2通入滴有酚酞的NaOH溶液中 | 溶液红色褪去 | SO2具有漂白性 |
| C | 将稀盐酸滴入Na2SiO3溶液中 | 溶液中出现凝胶 | 非金属性:Cl>Si |
| D | 将稀硫酸滴入淀粉溶液中,加热一段时间,再加入新制的Cu(OH)2悬浊液并加热 | 溶液中未出现砖红色沉淀 | 淀粉未水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水(AgNO3溶液) | B. | NaOH溶液[Ba(OH)2溶液] | ||
| C. | FeSO4溶液(KSCN溶液) | D. | KI溶液(淀粉溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中国古代利用明矾溶液淸除铜镜表面的铜锈,是利用了明矾的酸性 | |
| B. | 碘是人体内必须的微量元素,所以富含高碘酸钾的食物适合所有人群 | |
| C. | “光化学烟雾”“臭氧空洞”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| D. | 用加入足量氢氧化钠溶液共热的方法可以区分地沟油与矿物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐卤点豆腐,明矾净水和利用电泳来分离各种氨基酸和蛋白质都与胶体的性质有关 | |
| B. | 人工制造的铝硅酸盐分子筛可用作吸附剂和催化剂载体 | |
| C. | 生物柴油可以用廉价油脂与甲醇发生酯交换反应制得,属于不可再生能源 | |
| D. | 在建的国产航母采用了新的防腐蚀技术,传统的船舶防腐蚀技术是在船体上焊接一些锌块,原理是采用牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 物质 | 甲 | 乙 | 丙 |
| A | N2 | O2 | H2 |
| B | Al | 盐酸 | Fe2O3 |
| C | SiO2 | Cl2 | NaOH(aq) |
| D | SO2 | 氨水 | NaHCO3(aq) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
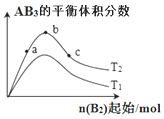 某化学科研小组研究在其它条件不变时,改变某一条件对化学反应:A2(g)+3B2(g)?2AB3(g)的平衡状态的影响时,得到如图所示的变化关系(图中T表示温度,n表示物质的量).下列推论正确的是( )
某化学科研小组研究在其它条件不变时,改变某一条件对化学反应:A2(g)+3B2(g)?2AB3(g)的平衡状态的影响时,得到如图所示的变化关系(图中T表示温度,n表示物质的量).下列推论正确的是( )| A. | 反应速率a>b>c | |
| B. | 若T2>T1,则正反应一定是放热反应 | |
| C. | 达到平衡时,AB3的物质的量大小关系:c>b>a | |
| D. | 达到平衡时,A2转化率的大小关系:a>b>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com