
| A.①②③④⑤⑥ | B.③④②①⑥⑤ |
| C.①③④②⑥⑤ | D.③①④②⑥⑤ |
科目:高中化学 来源:不详 题型:实验题
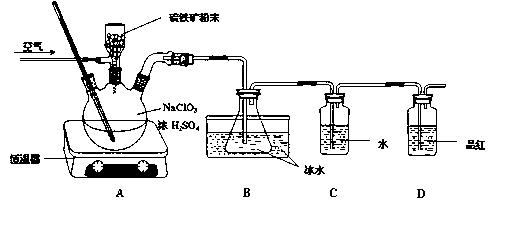
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

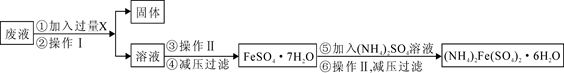
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
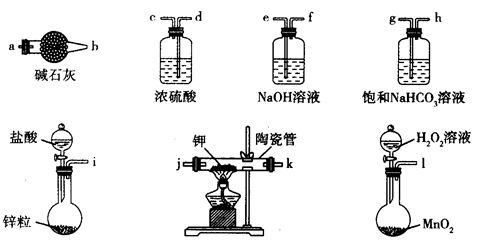
| A.Na2SO3溶液与稀硝酸 |
| B.Na2SO3固体与浓硫酸 |
| C.固体硫和氧气 |
| D.铜与浓硫酸 |
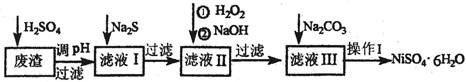
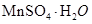 生产流程,其流程示意图如下:
生产流程,其流程示意图如下: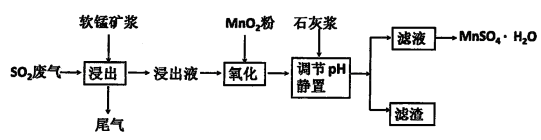
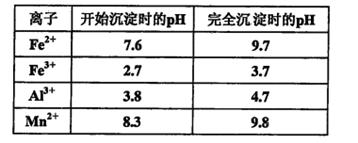
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
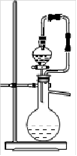
| A.过氧化钠和水反应制取氧气 |
| B.生石灰和浓氨水反应制取氨气 |
| C.二氧化锰和浓盐酸反应制取氯气 |
| D.碳化钙和饱和食盐水反应制取乙炔 |
查看答案和解析>>
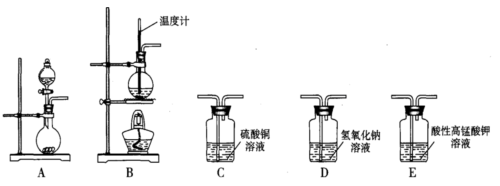
科目:高中化学 来源:不详 题型:实验题
| 实验 | 气体 | 所用装置 | 气体性质 | 干燥该气体选用的试剂 |
| (1) | | ③ | 其水溶液显碱性 | |
| (2) | | | 1mol最多能与2molH2反应 | ⑩ |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
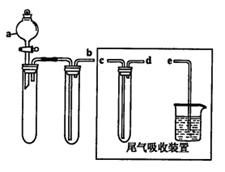
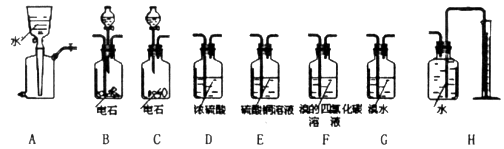
科目:高中化学 来源:不详 题型:实验题
| 序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
| (1) | 乙烯 | _________________ | _________________ |
| (2) | 乙炔 | A→C→E | _________________ |
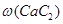 =_______________。
=_______________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com