
分析 A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同,则A为H元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,核外电子排布为1s22s22p2,故B为碳元素; D原子的核外成对电子数是未成对电子数的3倍,核外电子排布为1s22s22p4,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面,则M为HCHO;A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为C6H6;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,E原子核外电子数为18+4=22,故E为Ti,据此解答.
解答 解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同,则A为H元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,核外电子排布为1s22s22p2,故B为碳元素; D原子的核外成对电子数是未成对电子数的3倍,核外电子排布为1s22s22p4,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面,则M为HCHO;A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为C6H6;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,E原子核外电子数为18+4=22,故E为Ti.
(1)a.HCHO中O氧原子电负性很大,能与与水分子形成氢键,易溶于水,N为苯,是非极性分子,水分子为极性分子,相似相溶原理,苯难溶于水,故a正确;
b.HCHO中C原子形成3个σ键,没有孤电子对,碳原子采用sp2杂化,二氧化碳分子为直线型结构,碳原子采用sp杂化,故b错误;
c.苯分子中H-C之间是s-sp2形成的σ键,C-C之间是sp2形成的σ键,苯分子中含有12个σ键和1个大π键,故c错误;
d.苯为平面结构,所有原子处于同一平面,故d正确,
故选:ad;
(2)工业上用含Ti的矿石[主要成分为FeTiO3(不溶于水,其中Fe为+2价)]作原料制取TiO2.矿石经过硫酸溶液浸泡,生成含TiO2+的溶液,再经稀释得TiO2•xH2O,这两步反应的离子方程式为:FeTiO3+4H+=Fe2++TiO2++2H2O、TiO2++(x+1)H2O=TiO2•XH2O+2H+,
故答案为:FeTiO3+4H+=Fe2++TiO2++2H2O、TiO2++(x+1)H2O=TiO2•XH2O+2H+;
(3)X和Y分别是B和C的氢化物,这两种氢化物都含有18电子,则X为C2H6、Y为N2H4,N2H4分子之间存在氢键,沸点高于C2H6,
故答案为:C2H6;N2H4;<.
点评 本题是对物质结构的考查,推断元素是解题关键,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 叙述 | 评价 |
| A | 乙酸乙酯在H218 O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有. |
| B | 淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | 错,淀粉水解后未加碱中和至溶液呈碱性. |
| C | 向卤代烃水解后的溶液中加入AgNO3溶液,根据沉淀颜色可以判断卤素原子种类 | 对,水解后溶液中有卤化氢,与AgNO3溶液反应生成卤化银沉淀. |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液不能鉴别乙醇溶液和乙酸溶液. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x的原子序数大于y的原子序数 | |
| B. | x的电负性小于y的电负性 | |
| C. | x的离子半径大于y的离子半径 | |
| D. | x的第一电离能小于y 的第一电离能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、H2S、PH3的稳定性依次减弱 | |
| B. | HClO4、H2SO4、H3PO4的酸性依次减弱(相同条件下) | |
| C. | CsOH、KOH、LiOH的碱性依次增强 | |
| D. | Na+、Mg2+、Al3+的离子半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
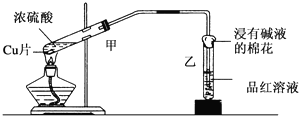
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
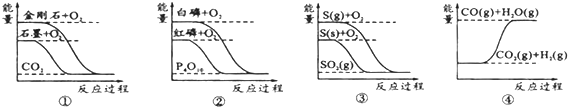
| A. | 石墨转变为金刚石是吸热反应 | |
| B. | 相同条件下,等质量S(g)和S(s)的能量比较,S(s)能量较高 | |
| C. | 白磷比红磷稳定 | |
| D. | CO(g)+H2O(g)═CO2(g)+H2(g)是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 福尔马林(甲酸) | Na2CO3溶液 | 蒸馏 |
| D | 苯(苯酚) | 溴 水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
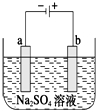 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加几滴石蕊溶液.下列实验现象描述正确的( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加几滴石蕊溶液.下列实验现象描述正确的( )| A. | 逸出气体的体积,a电极的小于b电极的 | |
| B. | 一电极逸出无味气体,另一电极逸出刺激性气体 | |
| C. | a电极附近呈红色,b电极附近呈蓝色 | |
| D. | a电极附近呈蓝色,b电极附近呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0,△H-T△S<0 | B. | △H<0,△H-T△S>0 | C. | △H>0,△H-T△S>0 | D. | △H<0,△H-T△S<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com