
 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.分析 (Ⅰ)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比,由碳元素守恒可知,反应物中有固体碳;
(Ⅱ)(1)根据v=$\frac{△c}{△t}$计算v(H2);
(2)Fe是固体,加入Fe后,平衡不移动;再继续通入1mol H2O(g),等效为开始通入2mol H2O(g),等效为在原平衡基础上增大压强,平衡不移动,水蒸汽转化率不变;
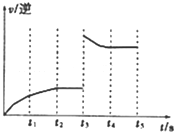
(3)如右图t3时刻,逆反应反应速率突然增大,而后逆反应速率减小,反应向逆反应进行.
解答 解:(Ⅰ)(Ⅰ)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比,由碳元素守恒可知,反应物中有固体碳,所以方程式为:C(s)+H2O(g)?CO(g)+H2 (g),
故答案为:C(s)+H2O(g)?CO(g)+H2 (g);
(Ⅱ)(1)v(H2)=$\frac{\frac{0.35mol-0.2mol}{5L}}{({t}_{2}-{t}_{1})s}$=$\frac{0.03}{{t}_{2}-{t}_{1}}$mol•L-1•s-1,
故答案为:$\frac{0.03}{{t}_{2}-{t}_{1}}$mol•L-1•s-1;
(2)Fe是固体,加入Fe后,平衡不移动;再继续通入1mol H2O(g),等效为开始通入2mol H2O(g),等效为在原平衡基础上增大压强,平衡不移动,水蒸汽转化率不变,达到平衡后H2物质的量为2×0.35mol=0.7mol,
故答案为:不;0.7;
(3)如右图t3时刻,逆反应反应速率突然增大,而后逆反应速率减小,反应向逆反应进行,可能是增大氢气浓度,正反应为放热反应,也可能是升高温度,
故答案为:升高了温度或增大了H2的浓度.
点评 本题考查化学平衡计算及影响因素、反应速率计算、平衡常数等,侧重考查学生分析解决问题能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Cu是氧化剂 | B. | FeCl3是还原剂 | ||
| C. | Cu在反应中失去电子 | D. | FeCl3发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A. | 实验①中,若5min 时测得 n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol/min | |
| B. | 实验②中,该反应的平衡常数K=2.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 实验④中,达到平衡时,b>0.060 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前2 s,以N2O4的浓度表示的平均反应速率为 0.01 mol•L-1•s-1 | |
| B. | 在2 s时体系内的压强为开始时的1.1倍 | |
| C. | 在平衡时体系内含N2O40.25 mol | |
| D. | 平衡时,如果压缩容器容积,则可提高N2O4的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3)(7)(9)(10)(11)(12) | B. | (3)(7)(9)(10)(11)(14) | C. | (3)(7)(8)(9)(10)(11)(12) | D. | (1)(3)(7)(8)(9)(10)(11)(12) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | CO32-、AlO2-、NO3- |
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n(Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n(Br-) | 3.0mol | 2.8mol | 1.8mol |
| n(I-) | X mol | 0 | 0 |
| A. | X=0.3 | |
| B. | 溶液中n(Cl-):n(Br-):n(I-)=10:15:4 | |
| C. | 加入的氢氧化钠溶液的浓度为1.45mol•L-1 | |
| D. | 溶液中大量存在的离子共有六种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe与足量盐酸反应,转移的电子总数为1.806×1024个 | |
| B. | 常温常压下,1 mol羟基(-OH)所含电子数为6.02×1024个 | |
| C. | 常温常压下,34g H2O2中含有共用电子对数为1.806×1024个 | |
| D. | 58.5gNaCl晶体中离子总数为6.02×1023个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com