
| A. | 254gI2(g)中通入2g H2(g),反应放热9.48kJ | |
| B. | 反应(ii)的反应物总能量比反应(i)的反应物总能量低 | |
| C. | 反应(i)的产物比反应(ii)的产物稳定 | |
| D. | 1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
分析 已知:(i)I2(g)+H2(g)?2HI(g)△H=-9.48kJ•mol-1;(ii)I2(s)+H2(g)?2HI(g)△H=+26.48kJ•mol-1,利用盖斯定律将①-②可得I2(g)=I2(s)△H=-9.48kJ•mol-1-26.48kJ•mol-1=-35.96kJ•mol-1,根据二者转化的热化学方程式判断.
解答 解:已知:(i)I2(g)+H2(g)?2HI(g)△H=-9.48kJ•mol-1;(ii)I2(s)+H2(g)?2HI(g)△H=+26.48kJ•mol-1,利用盖斯定律将①-②可得I2(g)=I2(s)△H=-9.48kJ•mol-1-26.48kJ•mol-1=-35.96kJ•mol-1,
A.n(I2)=$\frac{254g}{254g/mol}$=1moL,n(H2)=1mol,由于该反应为可逆反应,则放出的热量小于9.48kJ,故A错误;
B.由I2(g)=I2(s)△H=-35.96kJ•mol-1,可知I2(g)能量大于I2(s),所以反应(ii)的反应物总能量比反应(i)的反应物总能量低,故B正确;
C.反应(i)(ii)的产物都是HI,状态相同,稳定性相同,故C错误;
D.由I2(g)=I2(s)△H=-35.96kJ•mol-1,可知1mol固态碘与1mol气态碘所含的能量相差35.96kJ,故D错误.
故选B.
点评 本题考查化学反应与能量,明确盖斯定律的应用是解答该题的关键,注意物质的稳定性与能量高低的关系,易错点为A,注意反应为可逆反应的特征.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | ||
| Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 酸性强弱:H2SiO3<H2CO3<H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)下列数据是对应物质的熔点(℃)
(1)下列数据是对应物质的熔点(℃)| NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
 )所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.
)所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.| 化学键 | Si-O | Si-Si | O=O |
| 键能/KJ•mol-1 | 460 | 176 | 498 |
 )之间脱去两个水分子产物,其结构式为
)之间脱去两个水分子产物,其结构式为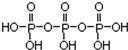 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正价B<A=C | |
| B. | A、B形成的化合物中只含有离子键,A、C形成的化合物中只含有共价键 | |
| C. | A、B、C三种元素能组成两种不同的化合物 | |
| D. | A、C形成的一种化合物既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使澄清石灰水变浑浊的气体一定是CO2 | |
| B. | 能使品红溶液褪色,将其煮沸又变红的无色气体为SO2 | |
| C. | 与浓H2SO4反应可产生SO2的一定是亚硫酸的正盐 | |
| D. | 某酸性溶液经分析含大量S2-,SO42-,MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 以油脂为燃料的微生物燃料电池是处理地沟油的理想方法.本题以乙酸乙酯替代油脂的生物燃料电池的结构如图所示.下列叙述正确的是( )
以油脂为燃料的微生物燃料电池是处理地沟油的理想方法.本题以乙酸乙酯替代油脂的生物燃料电池的结构如图所示.下列叙述正确的是( )| A. | 该电池能够在高温下工作 | |
| B. | 放电过程中,H+从左侧区向右侧区迁 | |
| C. | 负极反应为:C4H8O2+6H2O-20e-═4CO2↑+20H+ | |
| D. | 电池工作时右侧区域的pH将升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com