
| ѡ�� | �������ʵ | ���� |
| A | �����ھƾ����ϼ��ȣ��ܻ����Һ̬�������� | ���۵����������Ĥ�����������棬��ֹ��Һ̬������ |
| B | Ư���ڿ����о��ñ��� | Ư���е�CaCl2������е�CO2��Ӧ����CaCO3 |
| C | ��������Ũ�����в��ܽ⣬����ɫ������� | ����Ũ����ۻ��������γ����ܵ�����Ĥ����ֹ�ڲ������������ᷴӦ |
| D | Na�Ż�����ˮ��� | Na��ˮ���ҷ�Ӧ����������ը |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A�����������۵���������۵㣬������Ĥ��ס�ۻ��������䣻
B��Ư���д�����ƺͿ����еĶ�����̼ˮ����������Ӧ����̼��ƺʹ����ᣬ���������ֽ��������������
C��������Ũ�������ۻ������������������ܵ�����Ĥ��
D�����ý������ˮ��Ӧ����������
��� �⣺A������������Ӧ��������������������Ĥ��ס�ۻ��������䣬˵�����������۵���������۵㣬��A��ȷ��
B��Ư���ڿ����о��ñ��ʣ�Ư���д�����ƺͿ����еĶ�����̼ˮ����������Ӧ����̼��ƺʹ����ᣬ���������ֽ��������������ᣬƯ��ʧЧ����B����
C��������Ũ�������ۻ������������������ܵ�����Ĥ������������Ũ�������ۻ����ɱ����ڲ�������ʴ����C��ȷ��
D��Na��ˮ��Ӧ���������������ױ�ը��Ӧ��ɳ�����𣬹�D��ȷ��
��ѡB��
���� ���⿼�黯ѧʵ�鷽�������ۣ�Ϊ�߿��������ͣ�������ѧ���ķ���������Ԫ�ػ�����֪ʶ���ۺ���������õĿ��飬�ѶȲ���ע����ػ���֪ʶ�Ļ��ۣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| NO | N2 | CO2 | |
| ��ʼŨ��/mol•L-1 | 0.10 | 0 | 0 |
| ƽ��Ũ��/mol•L-1 | 0.04 | 0.03 | 0.03 |
 ���ٴδﵽƽ����������NO��N2��CO2��Ũ��ֵ��Ϊ5��3��3�����H��0�����������=����������
���ٴδﵽƽ����������NO��N2��CO2��Ũ��ֵ��Ϊ5��3��3�����H��0�����������=�����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| aת��Ϊb | aת��Ϊc | cת��Ϊb | |
| A | NaOH | Na | CO2 |
| B | Na2CO3 | NaOH | HCl |
| C | NaHCO3 | NaOH | CO2 |
| D | NaHCO3 | Na | HCl |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������Ԫ��X��Y��Z��W�����ڱ��е�λ����ͼ1��ʾ������W���������������γɵ���Ҫ���ʣ�
������Ԫ��X��Y��Z��W�����ڱ��е�λ����ͼ1��ʾ������W���������������γɵ���Ҫ���ʣ� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ƺ������ƾ�������DZͧ�еĹ����� | |
| B�� | ������������ȥ��ˮ������������������ | |
| C�� | �����������������ͻ����� | |
| D�� | ̼�����ƿ���������θ������ҩ�PʳƷ���ͼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2ʹƷ�졢���Ը��������Һ��ɫ���ֱ�����������Ư���Ժͻ�ԭ�� | |
| B�� | ��Fe��NO3��2��Ʒ����ϡH2SO4�μ�KSCN��Һ����Һ��죬˵��Fe��NO3��2��Ʒ�Ѿ����� | |
| C�� | ��δ֪��Һ�еμ�BaCl2��Һ���ְ�ɫ�����������ᣬ�������ܽ⣬˵������Һ��һ������SO42- | |
| D�� | �ᴿ������������ص��Ȼ��ƣ�Ӧ�����ڽϸ��¶����Ƶ�Ũ��Һ����ȴ�ᾧ�����ˡ�����ķ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
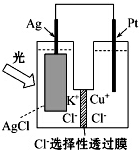 һ�ֹ⻯ѧ�Ľṹ��ͼ��ʾ������ܷ�ӦΪAgCl��s��+Cu+��aq���TAg��s��+Cu2+��aq��+Cl-��aq�������й��ڸõ���ڹ���ʱ��˵������ȷ���ǣ�������
һ�ֹ⻯ѧ�Ľṹ��ͼ��ʾ������ܷ�ӦΪAgCl��s��+Cu+��aq���TAg��s��+Cu2+��aq��+Cl-��aq�������й��ڸõ���ڹ���ʱ��˵������ȷ���ǣ�������| A�� | ����108g����ת�Ƶ��Ӹ���Ϊ1mol | |
| B�� | Cu+�ڸ�������������Ӧ | |
| C�� | Ag�缫���ã�Agʧ���ӷ���������Ӧ | |
| D�� | Cl-�ɸ���Ǩ�Ƶ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �ɢ��֪X��һ������SiO2 | B�� | ���жϻ�������Ƿ���Na2O | ||
| C�� | 1.92 g����ɷ�ΪCu | D�� | 15.6 g�����X��m��Fe2O3����m��Cu��=1��1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com