
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl
的Ksp=4×10-10,下列说法不正确的是( )
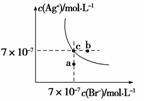
A.在t ℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
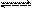 D.在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816
D.在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
把含硫酸铵和硝酸铵的混合液2a L分成两等份。一份加入bmol NaOH并加热,恰好把NH3全部赶出;另一份需消耗cmol BaCl2沉淀反应恰好完全,则原溶液中NO3- 的浓度为 ( )
A 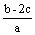 B
B 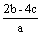 C
C 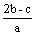 D
D 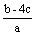
查看答案和解析>>
科目:高中化学 来源: 题型:
钠、铝、铁是三种重要的金属。请回答:
(1)将一小块金属钠投入水中,可观察到的实验现象是_____________(填字母)。
a.钠浮在水面上 b.钠熔成小球 c.小球四处游动 d.溶液变红
(2)铝与氢氧化钠浓溶液反应的化学方程式为_______________________________。
(3)三种金属中,常温下遇浓硫酸或浓硝酸不会发生钝化现象的是 (填化学式)。
(4)三种金属在一定条件下均能与水发生反应。其中铁与水蒸气在高温下反应的化学方程式为 。三种金属中,能与冷水发生剧烈反应的是 ,由此说明,钠的金属性比铁和铝 (填“强”或“弱”)。
(5)将烧得红热的铁丝伸到盛有氯气的集气瓶中,可观察到 。该反应的化学方程式为__________________________________________。
(6)某些补铁剂成分中含有硫酸亚铁,长期放置会因氧化而变质。检验硫酸亚铁是否变质的试剂是 (填序号)。
①稀盐酸 ②石蕊溶液 ③KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
人类的生活离不开化学,生活中的化学无处不在。请回答:
(1)家用铁锅用水清洗后放置一段时间,出现红棕色的锈斑。此过程中不可能发生的变化有
(填序号)。
①铁元素被氧化 ②铁元素被还原 ③铁元素由+3价转化为+2价
为防止铁锅生锈,将其洗净后,可进一步采取的措施是 (填序号)。
①擦干 ②放在潮湿的地方
(2)抗酸药物的作用是中和胃酸时过多的盐酸。某抗酸药物的主要成分是碳酸氢钠,写出碳酸氢钠与盐酸反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
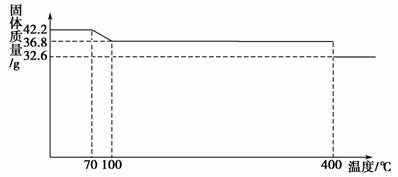
试回答下列问题:
(1)试确定150 ℃时固体物质的化学式_________________________________ _____________________________________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_____________________________________________________。
(3)在25 ℃时,将a mol·L-1的KCN溶液与0.01 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a________0.01 mol·L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____________________________________________________________。
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O===2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O,则另一个反应的离子方程式为____________________________________________________________。
上述转化的重要意义在于__________________________________ ______________________________________。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全________ _______________________________________________________________。
(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y为两种元素的原子,X的阴离子与Y的阳离子具有相同的电子层结构,由此可知( )
A.X的原子半径大于Y的原子半径
B.X的电负性大于Y的电负性
C.X阴离子的半径小于Y阳离子的半径
D.X的第一电离能小于Y的第一电离能
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2和Cl2均是常用的漂白剂,若将SO2和Cl2等物质的量混合后,先缓慢通入到BaCl2溶液中,再滴入品红试液,会观察到的现象是( )
A. 无沉淀生成,溶液显红色 B. 无沉淀生成,溶液显无色
C. 有沉淀生成,溶液显无色 D. 有沉淀生成,溶液显红色
查看答案和解析>>
科目:高中化学 来源: 题型:
11月19日,号称天下第一酒的酒鬼酒被媒体曝出塑化剂含量严重超标的丑闻。塑化剂的分子结构如下图所示:下列叙述中不正确的是( )
A.该物质的分子式为C24H38O4
B.该物质属于酯类,不溶于水
C.该物质能与溴水发生加成反应
D.该物质发生水解反应,其生成的醇只有一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com