
| 物 质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液.剩余固体备用. | 样品部分溶解,并有气体放出,说明有铝存在. |
| ② | 往试管A的剩余固体中加过量稀硫酸,充分反应后,静置.取上层清液于试管B中. | 固体部分溶解,并有气体放出,溶液呈浅绿色,可能含铁. |
| ③ | 往试管B中加入少许稀硝酸,再滴加KSCN溶液. | 溶液先变黄色,加KSCN后显血红色, 结合②可知,一定含铁. |
| ④ |


科目:高中化学 来源: 题型:
| A、①、③、② |
| B、①、③、④ |
| C、①、④、② |
| D、④、③、① |
查看答案和解析>>
科目:高中化学 来源: 题型:
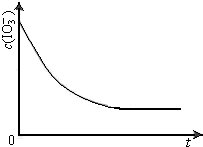
 4.53g硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.请通过计算确定400℃时剩余固体成分的化学式(写出计算过程).
4.53g硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.请通过计算确定400℃时剩余固体成分的化学式(写出计算过程).查看答案和解析>>
科目:高中化学 来源: 题型:
| M | ||
| X | Y | Z |
| A、Y的氢化物的沸点一定比M的氢化物的沸点高 |
| B、Z的最高价氧化物对应的水化物有可能是弱电解质 |
| C、这四种元素形成的晶体单质都是分子晶体 |
| D、单质M的晶体中可能含有共价键和分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14.3g |
| B、25.4g |
| C、28.6g |
| D、50.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为了快速配制好溶液,可以用容量瓶直接溶解氯化钠固体来配制溶液 |
| B、Cu中混有CuO,可以通过加入足量盐酸溶液,再过滤、洗涤烘干可得到洁净的Cu |
| C、设NA为阿伏伽德罗常数的值,1.0 L c(H+)=1.0mol/L的硫酸溶液中含有的H+数为NA |
| D、Fe(OH)3胶体是能产生丁达尔效应的分散系,而CuSO4溶液和蒸馏水是不能产生丁达尔效应的分散系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶质增加了3.5g |
| B、氢氧化钠的物质的量不变,而水被电解了1mol |
| C、氢氧化钠的消耗比水的消耗少 |
| D、氢氧化钠不参加反应,只有水参加反应,且放出H2和O2,消耗了18g水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “粤盐”精制盐的食品添加剂为KIO3、K4[Fe(CN)6](亚铁氰化钾);碘在科研与生活中有重要应用.
“粤盐”精制盐的食品添加剂为KIO3、K4[Fe(CN)6](亚铁氰化钾);碘在科研与生活中有重要应用.| 实验 序号 | 体积V/mL | ||||
| KIO3溶液 | 水 | H2SO4溶液 | Na2SO3溶液 | 淀粉溶液 | |
| ① | 12.0 | 0.0 | 6.0 | 10.0 | 2.0 |
| ② | 10.0 | X | 6.0 | 10.0 | 2.0 |
| ③ | 11.0 | 1.0 | 6.0 | 10.0 | 2.0 |
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | 取少量精制盐样品于洁净试管中,加入适量蒸馏水 | 得到无色溶液 | |
| ② | 试样含有K+ | ||
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.3g | B、3.1g |
| C、4.6g | D、5.3g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com