
现有5种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素.下列说法不正确的是( )
|
| A. | 原子半径:Y<Q<W |
|
| B. | ZX3可使紫色石蕊溶液变蓝 |
|
| C. | X、Z、Q 3种元素可组成离子化合物或共价化合物 |
|
| D. | X2Q2、Y2X62种分子中含有的电子数、化学键种类都相同 |
| 原子结构与元素周期律的关系.. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | X是周期表中原子半径最小的元素,应为H元素,X和W同主族,则W是Na或Li元素,Y元素原子核外电子总数是其次外层电子数的3倍,所以Y是C元素;W的原子序数大于Y,所以W是Na元素;Q元素是地壳中含量最高的元素,为O元素,Z的原子序数大于Y而小于Q,所以Z是N元素. A.同一周期,元素的原子半径随着原子序数的增大而减小,原子的电子层数越多,其原子半径越大; B.氨气的水溶液呈碱性; C.只含共价键的化合物是共价化合物,含有离子键的化合物是离子化合物; D.根据H2O2、C2H62种分子中含有的电子数、化学键种类判断. |
| 解答: | 解:X是周期表中原子半径最小的元素,应为H元素,X和W同主族,则W是Na或Li元素,Y元素原子核外电子总数是其次外层电子数的3倍,所以Y是C元素;W的原子序数大于Y,所以W是Na元素;Q元素是地壳中含量最高的元素,为O元素,Z的原子序数大于Y而小于Q,所以Z是N元素. A.C和O属于同一周期,碳原子半径大于氧原子半径,碳原子半径小于钠原子半径,所以原子半径:Q<Y<W,故A错误; B.氨气溶于水得到氨水,氨水电离出氢氧根离子而使溶液呈碱性,所以氨气可使紫色石蕊溶液变蓝,故B正确; C.铵盐属于离子化合物,硝酸是共价化合物,故C正确; D.H2O2、C2H62种分子中含有的电子数都是18,化学键种类都是共价键,故D正确; 故选A. |
| 点评: | 考查元素周期律、微粒半径比较等,难度中等,正确推断元素是解本题的关键,注意半径比较规律与基础知识掌握. |


科目:高中化学 来源: 题型:
下列说法中错误的是( )
A.在豆浆中加入少量的石膏,能够使豆浆产生聚沉
B.温度越高,酶的催化效率越高
C.蛋白质水解生成氨基酸
D.浓硝酸能够使皮肤变成黄色,是由于浓硝酸与蛋白质发生了显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
|
| A. | 蒸馏水、氨水、氢氧化钡、二氧化硫 | B. | 纯盐酸、空气、硫酸、干冰 |
|
| C. | 胆矾、盐酸、铁、碳酸钙 | D. | 氧化钙、漂白粉、氧化铝、碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中,始终无明显现象的是( )
|
| A. | NO2通入FeSO4溶液中 | B. | CO2通入CaCl2溶液中 |
|
| C. | NH3通入AlCl3溶液中 | D. | SO2通入已酸化的Ba(NO3)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.已知:氧化性:IO3﹣>Fe3+>I2;还原性:S2O32﹣>I﹣3I2+6OH﹣═IO3﹣+5I﹣+3H2O;
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①加KSCN溶液显红色,该红色物质是 (用化学式表示);CCl4中显紫红色的物质是 (用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 .
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境下KI与氧气反应的化学方程式: .将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由 .
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+. .
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.某小组同学对一未知溶液进行了多次检测,其中三次检测结果如下表所示
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | MgSO4、NaNO3、KNO3、 |
| 第二次 | Mg (NO3)2、KNO3、Na2SO4 |
| 第三次 | Mg (NO3)2、Ba(NO3)2、Na2SO4 |
(1)三次检测结果中第 次检测结果肯定不正确。
Ⅱ.为了逐一除去溶液中SO42-和Mg2+并且最后所得溶液中不引入新的离子,该组同学选择适当试剂进行实验。可供选择的试剂有:稀HNO3、稀HCl、Ba(OH)2、Ba(NO3)2、NaOH、Na2CO3。相应的实验过程可用下图表示:
 |
(2)写出实验流程中试剂X的化学式 。
(3)请写出步骤②的离子方程式
(4)上述实验流程中加入过量Na2CO3的目的是 。
(5)按此实验方案得到的溶液3中肯定引入其他新的阴离子,可以向溶液3中加入适量的 除去,写出其中一个反应的离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
不具有放射性的同位素称之为稳定同位素,稳定同位素分析法近20年来在植物生理学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列有关说法正确的是( )
A.34S原子核内中子数为16
B.1H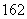 O和1H
O和1H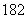 O的相对分子质量不同
O的相对分子质量不同
C.13C和15N原子核内的质子数相差2
D.2H+结合OH-的能力比1H+的更强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com