
【题目】有关物质的除杂,下列说法正确的是( )
A.除去KNO3溶液中的少量KCl,加过量AgNO3溶液并过滤
B.除去CO气体中混有的少量CO2,可通过足量的灼热的CuO
C.通过蒸馏除去自来水中混有的各种盐以获得蒸馏水
D.通过分液除去酒精中混有的水
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]。下列说法不正确的是
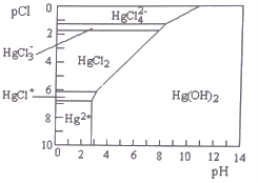
A. 可用如下方法除去污水中的Hg2+: FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq)
B. 当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在
C. HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCl++Cl-
D. 当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关,下列说法错误的是( )
A.以电解饱和食盐水制取氯气等产品的工业称为“氯碱工业”
B.氯气可用来对自来水杀菌消毒
C.碘化银可用于人工降雨
D.为了消除碘缺乏病,在食用盐中加入一定量的碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性气体电极。测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是

A. a极与电源的负极相连
B. 产物丁为硫酸溶液
C. 离子交换膜d为阴离子交换膜(允许阴离子通过)
D. b电极反立式为2H2O+2e-=2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯雌酚是一种激素类药物,结构如图,下列有关叙述不正确的是( ) 
A.它易溶于有机溶剂
B.1mol该有机物最多消耗NaOH和Na2CO3的物质的量均为2mol
C.1mol该有机物可以与5mol Br2发生反应
D.该有机物分子中,最多有14个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用pH= 1的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为x和y,则x和y的关系正确的是( )
A.x> y
B.x<y
C.x= y
D.x≤y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有水参与或生成的反应不属于取代反应的是( )
A.CH2═CH2+H2O ![]() CH3CH2OH
CH3CH2OH
B.![]()
C.CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
D.CH3CH2Cl+H2O ![]() CH3CH2OH+HCl
CH3CH2OH+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓(GaN)被称为第三代半导体材料,其应用已经取得了突破性的进展。
已知:(i)氮化镓性质稳定,不与水、酸反应,只在加热时溶于浓碱。
(ii)NiCl2 溶液在加热时,先转化为Ni(OH)2,后分解为NiO。
(iii)制备氮化镓的反应为:2Ga+2NH3![]() 2GaN+3H2
2GaN+3H2
某学校化学兴趣小组实验室制备氮化镓,设计实验装置如图所示:

设计实验步骤如下:
①滴加几滴NiCl2 溶液润湿金属镓粉末,置于反应器内。
②先通入一段时间后的H2,再加热。
③停止通氢气,改通入氨气,继续加热一段时间。
④停止加热,继续通入氨气,直至冷却。
⑤将反应器内的固体转移到盛有盐酸的烧杯中,充分反应过滤、洗涤、干燥。
(1)仪器X中的试剂是___________,仪器Y的名称是__________________。
(2)指出该套装置中存在一处明显的错误是________________________。
(3)步骤①中选择NiCl2 溶液,不选择氧化镍的原因是____________________。
a.增大接触面积,加快化学反应速率
b使镍能均匀附着在镓粉的表面,提高催化效率
c.为了能更好形成原电池,加快反应速率
(4)步骤③中制备氮化镓,则判断该反应接近完成时观察到的现象是____________________。
(5)请写出步骤⑤中检验产品氮化镓固体洗涤干净的操作________________________。
(6)镓元素与铝同族,其性质与铝类似,请写出氮化镓溶于热NaOH溶液的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。根据表中所列①~⑨元素,请按要求回答下列问题:
⑩ | ||||||||
① | ② | ③ | ||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素①形成的最高价氧化物的电子式为__________ ,⑤⑨两种元素形成的化合物的电子式为__________,①~⑨元素的最高价氧化物的水化物酸性最强的是__________ (填化学式)。
(2)①、⑦两种元素的最高价氧化物的熔点较高的是___________(填化学式)。
(3)由②③⑩三种元素组成的离子化合物中所含有的化学键有____________ 。
(4)①的单质与②的最高价氧化物的水化物的浓溶液反应的化学方程式为____________________。
(5)下列事实能说明③非金属性比⑧强的有___________。
a.③的单质与⑧的氢化物溶液反应,溶液变浑浊
b.③⑧形成简单离子时,得电子数目的多少
c.③与⑧两元素的简单氢化物受热分解,前者的分解温度高
d.③原子半径比⑧小
e.③与⑧两元素的简单氢化物的沸点,前者高
Ⅱ. 短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体, m 的摩尔质量为p的2倍,n是元素Y的单质, p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述的转化关系如图所示。下列说法正确的是__________ 。

A.原子半径:Y< X< Z
B.非金属性:Y> X> W
C.q与s均为酸性氧化物
D.常温下,m与q,n与s均不能共存
E.若n过量,q还可以继续燃烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com