
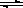 2N2O5(g)+5286 kJ��֪��ϵ��n(NO2)��ʱ��仯���±���
2N2O5(g)+5286 kJ��֪��ϵ��n(NO2)��ʱ��仯���±���| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
 2N2O5(g)�Ѵﵽƽ��״̬���ǣ�A��v��NO2��=4v��O2��û��˵����Ӧ�ķ�����֤����C��v����N2O5��=2v����O2�����ԣ� B�����ڸ÷�Ӧ��һ����������仯�ķ�Ӧ�����û�дﵽƽ��ѹǿ�϶������仯����������ѹǿ���ֲ������˵����D���������ܶ�ʼ�ձ��ֲ�����˵������ѡBC��
2N2O5(g)�Ѵﵽƽ��״̬���ǣ�A��v��NO2��=4v��O2��û��˵����Ӧ�ķ�����֤����C��v����N2O5��=2v����O2�����ԣ� B�����ڸ÷�Ӧ��һ����������仯�ķ�Ӧ�����û�дﵽƽ��ѹǿ�϶������仯����������ѹǿ���ֲ������˵����D���������ܶ�ʼ�ձ��ֲ�����˵������ѡBC��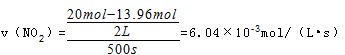 ,
, �ʴ�Ϊ��c��1.51��10-3mol/��L?s����
�ʴ�Ϊ��c��1.51��10-3mol/��L?s����

 ������ȫ�̼����ĩ���100��ϵ�д�
������ȫ�̼����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc(A)
C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc(A)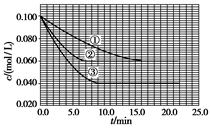
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
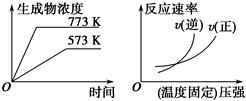
A��N2(g)��3H2(g) 2NH3(g) ��H����Q1 kJ��mol��1(Q1>0) 2NH3(g) ��H����Q1 kJ��mol��1(Q1>0) |
B��2SO3(g) 2SO2(g)��O2(g)��H����Q2 kJ��mol��1(Q2>0) 2SO2(g)��O2(g)��H����Q2 kJ��mol��1(Q2>0) |
C��4NH3(g)��5O2(g) 4NO(g)��6H2O(g)��H����Q3 kJ��mol��1(Q3>0) 4NO(g)��6H2O(g)��H����Q3 kJ��mol��1(Q3>0) |
D��H2(g)��CO(g) C(s)��H2O(g)��H����Q4 kJ��mol��1(Q4>0) C(s)��H2O(g)��H����Q4 kJ��mol��1(Q4>0) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
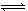 2NH3(g) ��H��0����ͼ����ʾ�ķ�Ӧ���ߣ�T��ʾ�¶ȣ�P��ʾѹǿ��C%��ʾNH3�����������������˵���в���ȷ����
2NH3(g) ��H��0����ͼ����ʾ�ķ�Ӧ���ߣ�T��ʾ�¶ȣ�P��ʾѹǿ��C%��ʾNH3�����������������˵���в���ȷ����
| A��T2��T1 |
| B��P2��P1 |
| C����P3��P4��y���ʾN2��ת���� |
| D����P3��P4��y���ʾNH3��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

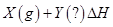 ����
����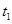 ʱ�̷�Ӧ�ﵽƽ�⣬��
ʱ�̷�Ӧ�ﵽƽ�⣬��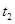 ʱ����С���������
ʱ����С���������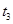 ʱ���ٴδﵽƽ��״̬��δ�ٸı������������й�˵������ȷ����
ʱ���ٴδﵽƽ��״̬��δ�ٸı������������й�˵������ȷ����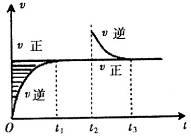
| A��Z��W�ڸ�������������һ����Ϊ��̬ |
B��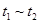 ʱ����� ʱ�����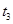 ʱ�̺���ʱ��η�Ӧ��ϵ�������ƽ��Ħ��������������� ʱ�̺���ʱ��η�Ӧ��ϵ�������ƽ��Ħ��������������� |
C�����ڸ��¶��´˷�Ӧƽ�ⳣ������ʽΪK=c��X������ ʱ����� ʱ����� ʱ�̺��XŨ�Ȳ���� ʱ�̺��XŨ�Ȳ���� |
D�����÷�Ӧֻ��ij�¶� �����Է����У���÷�Ӧ��ƽ�ⳣK���¶����߶����� �����Է����У���÷�Ӧ��ƽ�ⳣK���¶����߶����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)��H2O(g) ��H �� ��49.0 kJ��mol��1��
CH3OH(g)��H2O(g) ��H �� ��49.0 kJ��mol��1��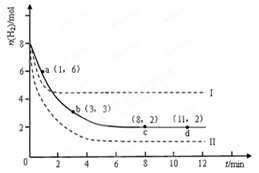
| A��0��1min | B��1��3min | C��3��8min | D��8��11min |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2��H2(g)��Ӧ�����вⶨ�IJ������ݼ��±�������t1��t2����
CO2��H2(g)��Ӧ�����вⶨ�IJ������ݼ��±�������t1��t2����| ��Ӧʱ��/min | n(CO)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
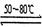 Ni(CO)4(g) ��H �� 0
Ni(CO)4(g) ��H �� 0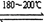 Ni(����s)+4CO(g) ��H �� 0
Ni(����s)+4CO(g) ��H �� 0| A�����ڷ�Ӧһ���ʵ�����ѹǿ��������Ni(CO)4������ |
| B���ᴿ�����У�CO�����ѭ��ʹ�� |
| C�������¶ȣ���Ӧһ�ķ�Ӧ���ʼ�С����Ӧ������������ |
| D���Է�Ӧ������180��200�棬�¶�Խ�ߣ�Ni(CO)4(g)��ת����Խ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com