
����Ŀ�����ⶨijHCl��Һ�����ʵ���Ũ�ȣ�����0.1000mol��L-1NaOH����Һ�����к͵ζ����÷�̪��ָʾ������
��ش��������⣺
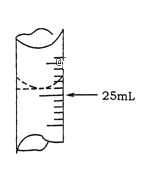
(1)����ѧ����ʵ������У���¼�ζ�ǰ�ζ�����Һ�����Ϊ1.10mL���ζ���Һ����ͼ�����ʱ���ı���Һ�����Ϊ ___________��
(2)��ѧ����������ƽ��ʵ�飬���ݼ�¼���£�
ʵ�� ��� | ����HCl��Һ�����/mL | 0.1000mol��L-1NaOH��Һ�����/mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
ѡȡ�����������ݣ������HCl������Һ�����ʵ���Ũ��Ϊ ________mol��L-1��С���������λ����
(3)�ζ�ʱ����ȷ������_____________________________________________________���ζ��ﵽ�յ��������_____________________________________________����ʱ��ƿ����Һ��pH�ķ�Χ��________��
(4)������Щ������ʹ�ⶨ���ƫ��_______________������ţ���
A����ƿ������ˮϴ�������ô���Һ��ϴ
B����ʽ�ζ���������ˮϴ�������ñ�Һ��ϴ
C���ζ�ǰ��ʽ�ζ��ܼ������δ�ų����ζ���������ʧ
D���ζ�ǰ������ȷ���ζ����ӵζ��ܶ���
���𰸡�23.80mL 0.1044 ���ֿ��ƻ��������ֲ���ҡ����ƿ���۾�ע����ƿ����Һ��ɫ�ı仯 ���������һ��NaOH��Һ����ʱ����Һ��ɫǡ������ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ 8.2��10.0 AC
��������
(1)���ݵζ����Һ��ͼ��Һ�������24.90 mL�����ı���Һ����������ζ����IJ
(2)���ݱ������ݣ��ڶ���ʵ��ƫ��������Χ������1��3��ʵ�����ݼ�����������������Һ��ƽ�����������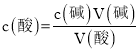 ����HCl������Һ�����ʵ���Ũ�ȡ�
����HCl������Һ�����ʵ���Ũ�ȡ�
(3)�����к͵ζ��Ĺ淶�����ش𣻵�����������������ȫ��Ӧʱ���ﵽ�ζ��յ㣬�ζ������У���ҺpH���ߣ�ָʾ����̪�ı�ɫ��Χ��8.2��10.0��
(4)����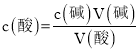 ������
������
(1) �ζ�ǰ�ζ�����Һ�����Ϊ1.10mL���ζ���Һ�������24.90 mL����ʱ���ı���Һ�����Ϊ24.90 mL-1.10mL= 23.80mL��
(2)���ݱ������ݣ��ڶ���ʵ��ƫ��������Χ�� 1��3����ʵ����������������Һ��ƽ�����Ϊ![]() =26.10mL��
=26.10mL��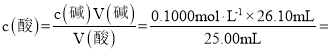 0.1044 mol��L-1��
0.1044 mol��L-1��
(3)�к͵ζ�ʱ�����ֿ��ƻ��������ֲ���ҡ����ƿ���۾�ע����ƿ����Һ��ɫ�ı仯���ζ������У���ҺpH���ߣ����Եζ��ﵽ�յ�������ǣ����������һ��NaOH��Һʱ����Һ��ɫǡ������ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ��ָʾ����̪�ı�ɫ��Χ��8.2��10.0����ʱ��ƿ����Һ��pH�ķ�Χ��8.2��10.0��
(4) A����ƿ������ˮϴ�������ô���Һ��ϴ���������ʵ������࣬���������������ƫ�ⶨ���ƫ�ߣ���ѡA��
B����ʽ�ζ���������ˮϴ�������ñ�Һ��ϴ����Ӱ�죬�ʲ�ѡB��
C���ζ�ǰ��ʽ�ζ��ܼ������δ�ų����ζ���������ʧ����������������Һ�����ƫ�ⶨ���ƫ�ߣ���ѡC��
D���ζ�ǰ������ȷ���ζ����ӵζ��ܶ���������������Һ�����ƫС���ⶨ���ƫ�ͣ��ʲ�ѡD��


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ѧ����־��������̫�յ�ijһ����Ĵ������У����д�����CH2=CHOH�������ʳ���ʱΪҺ�壬��������ת����CH3CHO����ѧ����ʽΪCH2=CHOH![]() CH3CHO����֪��H<0���ݴ�����Ϊ����˵���д������
CH3CHO����֪��H<0���ݴ�����Ϊ����˵���д������
A.����������¶Ⱥܸ�B.����������¶Ⱥܵ�
C.�÷�ӦΪ���ȷ�ӦD.�������ȶ���CH2=CHOH>CH3CHO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��KI��Һ�д���ƽ��
��KI��Һ�д���ƽ��![]() ��ij
��ij![]() ��KI�����Һ�У�
��KI�����Һ�У�![]() �����ʵ���Ũ��
�����ʵ���Ũ��![]() ���¶�T�Ĺ�ϵ��ͼ��ʾ
���¶�T�Ĺ�ϵ��ͼ��ʾ![]() �����ϵ��κ�һ�㶼��ʾƽ��״̬
�����ϵ��κ�һ�㶼��ʾƽ��״̬![]() ������˵����ȷ���ǣ� ��
������˵����ȷ���ǣ� ��

��![]()
�����¶�Ϊ![]() ��
��![]() ʱ��Ӧ��ƽ�ⳣ���ֱ�Ϊ
ʱ��Ӧ��ƽ�ⳣ���ֱ�Ϊ![]() ��
��![]() ����
����![]()
������Ӧ���е�״̬Dʱ��һ����![]()
��״̬A��״̬B��ȣ�״̬A��![]() ��
��
�ݱ����¶Ȳ��䣬��û����Һ�м�ˮ��![]() �����
�����
A.ֻ�Т٢�B.ֻ�Тڢ�C.�٢ۢ�D.�٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ�һ������NaClO2�Ĺ������£�

��֪����ClO2��һ��ǿ���������壬Ũ�ȴ�ʱ�ֽⱬը��������ʹ��ʱҪ��ϡ�����������Ƚ���ϡ�ͣ�ͬʱ������ա��ȡ���NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO2��3H2O������38��ʱ�����ľ�����NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl���ش��������⣺
��1�������ѧ�����ڡ���Ӧ������Ļ������о�����H2C2O4����SO2�Ʊ�ClO2���·������÷����Ļ�ѧ����ʽΪ___�����·�����ͻ�����ŵ���___��
��2����ò�ƷNaClO2�ġ��������������²��裺
�ټ�ѹ��55�������ᾧ���ڳ��ȹ��ˣ���___���ܵ���60�����õ���Ʒ��
��3��Ϊ�˲ⶨ��ƷNaClO2�Ĵ��ȣ�ȡ�������ò�Ʒ12.5g����ˮ���1L��Һ��ȡ��10.00mL��Һ����ƿ�У��ټ��������ữ��KI���ơ���ַ�Ӧ��(ClO2������ԭΪCl�������ʲ��μӷ�Ӧ)������2��3�ε�����Һ����0.25mol��L��1Na2S2O3��Һ�ζ����ﵽ�ζ��յ�ʱ��ȥ��Һ20.00mL���Լ����ƷNaClO2�Ĵ���___��(��ʾ��2Na2S2O3��I2��Na2S4O6��2Nal)
��4��NaClO2��Һ�д���ClO2��HClO2��ClO2����Cl�����ֺ����������ⶨ25���������Ũ����pH�ı仯�����ͼ��ʾ(Cl��û�л���)��

������������NaClO2��Һ�д��ڵ�Cl��ԭ����___(�����ӷ���ʽ����)��
��pH��5ʱ��NaClO2��Һ��ClO2��HClO2��ClO2����Cl�����ֺ�������Ũ���ɴ�С��˳����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���������������Ͷ����������γ�����ʱ������еİ��йأ�����ͼ��ʾ�������������������

A. �������ķ�ɢ����ͬ
B. �����к�������狀������
C. NH3���γ���������Ĵ���
D. �������γ������ʩ�õ����й�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С���KSCN�����ʽ���̽�����������ʵ�飺
�Թ����Լ� | ʵ�� | �μ��Լ� | ���� |
KSCN��Һ | �� | i.�ȼ�1 mL 0.1 mol/L FeSO4��Һ ii.�ټ������ữ��KMnO4��Һ | i.���������� ii.�ȱ�죬����ɫ |
�� | iii.�ȵμ�1 mL 0.05 mol/L Fe2(SO4)3��Һ iv.�ٵμ�0.5 mL 0.5 mol/L FeSO4��Һ | iii.��Һ��� iv.��ɫ���Ա�dz |
(1)�������ӷ���ʽ��ʾʵ��I��Һ����ԭ��___________
�����ʵ��I�к�ɫ��ȥ��ԭ��С��ͬѧ��Ϊ��SCN������KMnO4����ΪSO42���������ͼʵ��װ��֤ʵ�˲����dz����ġ�
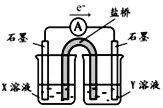
����X��Һ��_____________���������SO42�IJ�����������__________��
(2)���ʵ�������ɫ���Ա�dz����ʵ��С�����Ԥ�⡣
ԭ��٣�������ǿ����ʺ����������Ӽ�����ã�����֮��ǣ��������ǿ��������ЧӦ��������ЧӦ��ʹFe3++SCN![]() [Fe(SCN)]2+ƽ����ϵ�е�Fe3+��SCN��ϳ�[Fe(SCN)]2+�Ļ�����٣���Һ��ɫ��dz��
[Fe(SCN)]2+ƽ����ϵ�е�Fe3+��SCN��ϳ�[Fe(SCN)]2+�Ļ�����٣���Һ��ɫ��dz��
ԭ��ڣ�SCN������Fe2+��Ӧ������ɫ������ӣ���һ��ʹFe3++SCN![]() [Fe(SCN)]2+ƽ�����ƣ���ɫ���Ա�dz��
[Fe(SCN)]2+ƽ�����ƣ���ɫ���Ա�dz��
��֪��Mg2+��SCN����ϣ�����С�����������ʵ�飺
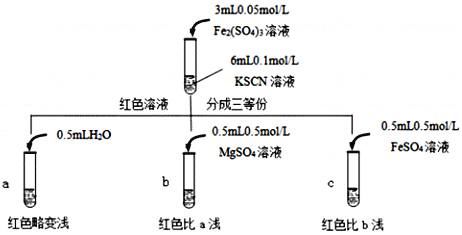
�ɴ��Ʋ⣬ʵ�������ɫ���Ա�dz����ԭ����___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E������Һ�ֱ���NaOH��NH3��H2O��CH3COOH ��HCl��NH4HSO4�е�һ�֡������½�������ʵ�飺
����1 L pH=3��A��Һ�ֱ���0.001mol��L��1 xL B��Һ��0.001mol��L��1 yL D��Һ��ַ�Ӧ�����ԣ�x��y��С��ϵΪ�� y��x��
��Ũ�Ⱦ�Ϊ0.1mol��L��1A��E��Һ��pH��A��E��
��Ũ�Ⱦ�Ϊ0.1mol��L��1C��D��Һ�������ϣ���Һ�����ԡ�
�ش��������⣺
(1)C��______��Һ��D��______��Һ��
(2)100mL0.01molL��1��B��Һ��10mL 0.1molL��1��B��Һ��Ƚϣ�������ֵ�У�ǰ�ߴ��ں��ߵ���______ (��д���)
��![]() ��
��![]() �� c��H+����c��OH-���ij˻� �� OH�������ʵ���
�� c��H+����c��OH-���ij˻� �� OH�������ʵ���
(3)OH��Ũ����ͬ�ĵ������������ҺA��E���ֱ���п�۷�Ӧ����������һ����Һ�д���п�ۣ��ҷų�������������ͬ��������˵����ȷ����________(��д���)
����Ӧ����Ҫ��ʱ��E>A ����ʼ��Ӧʱ������A>E
���μӷ�Ӧ��п�����ʵ���A=E ����Ӧ���̵�ƽ������ E>A
��A��Һ����п��ʣ�� ��E��Һ����п��ʣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ���ղ����е���(����)
A.N2![]() NO
NO![]() NO2
NO2 ![]() HNO3
HNO3
B.ʯӢɰ![]() �ֹ�
�ֹ�![]() ��SiCl4
��SiCl4![]() �ߴ���
�ߴ���
C.��ȡʳ�κ��ĸҺ![]() ��Br2����Һ
��Br2����Һ![]() ��
��![]() ��Br2
��Br2![]() Br2
Br2
D.������![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3![]() Al
Al
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����̽��̼��Ũ���ᷴӦ���������ͬѧ�����ͼ1װ�ã���Ϊ���к���ɫ���������˵��̼��Ũ���ᷢ���˷�Ӧ��
��1����ͬѧ��Ϊ��ͬѧ�Ľ����Ǵ���ģ�����������__________________________(�û�ѧ����ʽ��ʾ)����������ΪӦ�ü���__________(�ѧʽ)�IJ�����֤��̼��Ũ���ᷴӦ��Ϊ����ͬѧ����������ϵ�֪��0��ʱ����������ΪҺ�������Ӷ��Ľ���ʵ��װ����ͼ2��ʾ��

��2��Ϊ�˼��ٸ��ţ�����Aװ��������4�ֲ���������������������ǣ���д������ţ�_______��
�ٽ�̿��Ũ����һͬ����װ���м��ȣ����ȼ���Ũ���ᣬȻ��̿Ͷ�����У�
���ȼ���̿���ټ�����Ũ��� ���ȼ���̿���ٽ�̿Ͷ����Ũ���ᡣ
��3������ƽ���ƶ�ԭ������Bװ�õ�����____________________________________��
��4��Cװ���г��ֵ�������_______________________________________________�������C����Һ�л�����������Ԫ�أ�ֻ��NO3����ʽ���ڣ�д�����ɸ����ӵĻ�ѧ����ʽ___________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com