

分析 纯化工业级氧化锌和稀硫酸反应导致溶液中存在Fe2+、Mn2+、Zn2+和Ni2+,向浸出液中加入适量高锰酸钾溶液并调节溶液的pH约为5,Ni(Ⅱ)不能被氧化,Fe2+、Mn2+被氧化而被除去,同时溶液中有MnO2生成,过滤后,向滤液中加入Zn过滤,Zn和Ni2+发生氧化还原反应生成Ni,溶液中存在Zn2+,向滤液中加入碳酸钠溶液,生成ZnCO3•xZn(OH)2沉淀,煅烧碳酸锌沉淀生成ZnO,
(1)根据题意,Ni(Ⅱ)不能被氧化,反应②中除掉的杂质离子是Fe2+和Mn2+;
(2)反应③中加入Zn后,由于Zn比Ni活泼,可置换出Ni,以达到除Ni的目的;
(3)加高锰酸钾溶液前,若pH较低,铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质;
(4)检验沉淀是否洗涤干净的方法是最后一次洗涤液,检验表面是否含有硫酸根离子;
(5)根据关系式ZnCO3•xZn(OH)2~(x+1)ZnO来计算.
解答 解:(1)纯化工业级氧化锌和稀硫酸反应导致溶液中存在Fe2+、Mn2+、Zn2+和Ni2+,向浸出液中加入适量高锰酸钾溶液并调节溶液的pH约为5,Ni(Ⅱ)不能被氧化,Fe2+、Mn2+被氧化而被除去,故答案为:Fe2+和Mn2+;
(2)反应③中加入Zn后,由于Zn比Ni活泼,可置换出Ni,以达到除Ni的目的,反应方程式为:Zn+Ni2+═Ni+Zn2+,此反应为置换反应,如果锌过量则在滤渣中会有多余的锌,
故答案为:置换反应; 镍(Ni);
(3)在本实验条件下,Mn2+被氧化为MnO2,反应②中除掉的杂质离子是Fe2+和Mn2+,发生的离子方程式为MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;加高锰酸钾溶液前,若pH较低,铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质;
故答案为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质;
(4)由于溶液中硫酸根离子属于杂质离子,因此可以检验测定洗涤液中是否存在硫酸根离子,操作为:取最后一次少量水洗液于试管中,滴入1~2滴稀盐酸,再滴入氯化钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净,
故答案为:取最后一次少量水洗液于试管中,滴入1~2滴稀盐酸,再滴入氯化钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净;
(5)ZnCO3•xZn(OH)2$\frac{\underline{\;高温\;}}{\;}$(x+1)ZnO+xH2O↑+CO2↑
125+99x (x+1)×81
11.2 8.1
$\frac{125+99x}{11.2}$=$\frac{(x+1)×81}{8.1}$,
x=1,
故答案为:1.
点评 本题综合考查混合物的分离和提纯,为高频考点,侧重考查学生分析问题、解答问题能力,明确流程图中各个步骤发生的反应及溶液中存在的微粒,知道常见离子的检验方法及实验现象,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-5:10-7m之间 | |
| B. | 光线透过胶体时,胶体中可发生丁达尔效应 | |
| C. | Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 | |
| D. | 用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积数据 | B. | 体积分数 | C. | 质量分数 | D. | 物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥⑦⑧⑨ | B. | ①②④⑥⑦⑧⑨ | C. | ①③④⑤⑥⑧⑩ | D. | ①②④⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
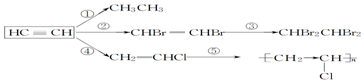
 ,加聚反应.
,加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡向正向移动,反应物浓度一定降低 | |
| B. | 化学平衡向正向移动,生成物的浓度一定增加 | |
| C. | 化学平衡向正向移动,反应物的转化率一定增大 | |
| D. | 化学平衡向正向移动时,正反应速率一定大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
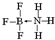 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素在人体内可以水解成葡萄糖 | |
| B. | 组成蛋白质的元素中,一定含有碳、氢、氧、氮 | |
| C. | 适量摄入油脂,有助于人体吸收多种脂溶性维生素 | |
| D. | 天然蛋白质水解后的最终产物是a-氨基酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com