
【题目】下列离子的检验方法正确的是( )
A. 某溶液![]() 产生白色沉淀,说明原溶液中有Cl-
产生白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 产生白色沉淀,说明原溶液中有SO
产生白色沉淀,说明原溶液中有SO![]()
C. 某溶液![]() 产生蓝色沉淀,说明原溶液中有Cu2+
产生蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO
生成无色气体,说明原溶液中有CO![]()
【答案】C
【解析】
A项,与硝酸银溶液生成白色沉淀的离子有Cl-、SO42-等;
B项,与氯化钡溶液生成白色沉淀的离子有SO42-、Ag+等;
C项,与氢氧化钠生成蓝色沉淀的离子只有铜离子;
D项,与稀硫酸生成无色气体的离子有CO32-、HCO3-、SO32-等;
A.某溶液中加入硝酸银溶液有白色沉淀生成,则白色沉淀可能是氯化银、硫酸银、亚硫酸银等,不能说明原溶液中有Cl-,故A项错误;
B.某溶液加入氯化钡溶液有白色沉淀生成,则白色沉淀可能为氯化银、硫酸钡等,不能说明原溶液中有SO42-,故B项错误;
C.某溶液加入氢氧化钠溶液有蓝色沉淀生成,蓝色沉淀为氢氧化铜,说明原溶液中有 Cu2+,故C项正确;
D.某溶液加入稀硫酸生成无色气体,无色气体可能是二氧化碳、二氧化硫等,不能说明原溶液中有CO32-,故D项错误。
综上所述,本题选C。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】下列哪种物质所含原子数与0.2 mol H3PO4所含原子数相等( )
A.0.4 mol H2O2B.0.2 mol H2SO4
C.0.9 mol NaClD.0.3 mol HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述中正确的是( )
A.化合反应一定是氧化还原反应
B.氧化还原反应的本质是元素化合价的升降
C.金属单质在化学反应中一定作还原剂
D.失电子的反应物在反应中作还原剂,反应中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):

(1)若A是一种金属,C是淡黄色固体,则B的化学式为________,A→C反应的化学方程式为___________________,C与H2O反应的化学方程式____________________。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为________,B→C反应的化学方程式为_____________________。A和C能否反应?________(填“能”或“不能”),若能,写出反应的化学方程式: _________________________(若不能,此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,能大量共存的离子组是
A.K+、Na+、CO32-、NO3-B.Ag+、Na+、SO42-、Cl-
C.OH-、HCO3-、Ca2+、Na+D.Ba2+、Na+、OH-、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀士氧化物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:

已知:①Ce4+能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
(1)焙烧过程中发生的主要反应方程式为____________________________________。
(2)“萃取”时存在反应:Ce4+ +n(HA)2![]() Ce·(H2n-4A2n)+4H+。
Ce·(H2n-4A2n)+4H+。
①实验室中萃取时用到的主要玻璃仪器为烧杯和__________________。
②右图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:____________________________________ 。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:____________________________________ 。
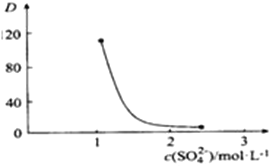
③在D=80的条件下,取20mL含四价铈总浓度为0. 1mol/L的酸浸液,向其中加入10mL萃取剂(HA)2,充分振荡,静置,水层中c(CeSO42+)=_________。 (结果保留三位有效数字)
(3) “反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作用与下列反应中H2O2的作用相同的是____________。
A. H2O2和MnO2混合制O2 B.用H2O2处理含酸性K2Cr2O7的废水
C.H2O2和CaO混合制备CaO2 D.用稀硫酸和H2O2的混合液溶解金属Cu
(4)溶液中c(Ce3+)等于1.0×10-5mol·L-1,可认为Ce3+沉淀完全,此时溶液的pH为______________,
(已知298K时,Ksp[Ce(OH)3]=1.0×10-20);“氧化过滤”步骤中氧化过程的离子方程式为 _____________________________________ 。
(5)取上述流程中得到的CeO2产品m g,加硫酸溶解后,加入V1mL a mol/L FeSO4溶液(足量),使铈被还原为Ce3+ (其它杂质均不反应,Ce3+为无色),用bmol/L的标准酸性KMnO4溶液去滴定过量的FeSO4,消耗标准溶液V2mL,则该产品中CeO2的质量分数为______ %;下列选项可能使测定结果偏低的是__________。
A.滴定前平视读数,滴定终点时仰视读数
B.滴定时锥形瓶内溶液变红就立即停止滴定
C.滴定管尖嘴部分滴定前无气泡,滴定终点有气泡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com