
| A. | 晶体中一定存在化学键 | |
| B. | 已知晶胞的组成就可推知晶体的组成 | |
| C. | 分子晶体在晶体态或熔融态下均不导电 | |
| D. | 原子晶体中只存在共价键,不可能存在其他类型的化学键 |
分析 A、稀有气体分子晶体中不存在任何化学键;
B、因为晶胞是能完整反映晶体内部原子或离子在三维空间分布;
C、分子晶体的构成微粒是分子;
D、原子晶体是原子间通过共价结合形成空间网状结构有晶体.
解答 解:A、稀有气体分子晶体中不存在任何化学键,所以晶体中不一定存在化学键,故A错误;
B、因为晶胞是能完整反映晶体内部原子或离子在三维空间分布,也是晶体中最小的结构单元,所以已知晶胞的组成就可推知晶体的组成,故B正确;
C、分子晶体的构成微粒是分子,所以分子晶体在晶体态或熔融态下均不导电,故C正确;
D、原子晶体是原子间通过共价结合形成空间网状结构有晶体,所以原子晶体中只存在共价键,不可能存在其他类型的化学键,故D正确;
故选A.
点评 本题考查物质的构成微粒和化学键,明确物质晶体类型、构成微粒及微粒间作用力即可解答,注意规律中的特例,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于稀硫酸中:Al+2H+═Al3++H2↑ | |
| B. | 碳酸锌溶于稀硝酸中:CO32-+2H+═H2O+CO2↑ | |
| C. | 氢氧化铝中和胃酸:OH-+H+═H2O | |
| D. | 少量Cl2通入KI溶液中:Cl2+2I-═2Cl-+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
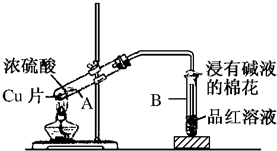
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
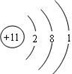 ;F元素在周期表中的位置是第三周期ⅦA族;
;F元素在周期表中的位置是第三周期ⅦA族;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
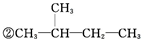 ③CH2=CH2④
③CH2=CH2④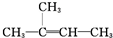 ⑤CH≡CH⑥CH3-C≡CH ⑦CH3-Cl ⑧CH3-CH2-Br⑨CH3-OH ⑩CH3-CH2-OH⑪CH3-COOH⑫CH3-COO-CH2-CH3⑬
⑤CH≡CH⑥CH3-C≡CH ⑦CH3-Cl ⑧CH3-CH2-Br⑨CH3-OH ⑩CH3-CH2-OH⑪CH3-COOH⑫CH3-COO-CH2-CH3⑬ ⑭
⑭ ⑮
⑮ ⑯
⑯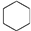
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O═HCl+HClO | B. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
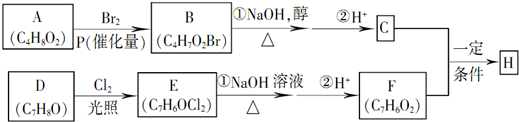
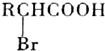
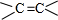 ;
;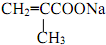 +NaBr+2H2O,该反应的类型为消去反应;
+NaBr+2H2O,该反应的类型为消去反应; $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +H2O.
+H2O.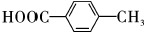 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com