
Ϊ�˷�ֹ�ȴ������ˮ����������豣��ˮ��Cu2+��Ũ��Լ1��2��10-5 mol��L-1��Ϊ������ÿ�λ���ˮʱ��ҺŨ�ȵĸı䣬�ɰ��ʵ��ĺ�ͭ��������ڳصף��䱥����Һ�ṩ�ʵ���Cu2+����֪CuS��Cu(OH)2��CuCO3��Kspֵ����Ϊ1��3��10-36��2��2��10-20��1��4��10-10���������������У��������ˮŨ��Ҫ�����
A��CuS B��Cu(NO3)2 C��Cu(OH)2 D��CuCO3
D
��������
���������CuS��s��?Cu2++S2-��Ksp��CuS��=c��Cu2+��c��S2-��=1.3��10-36������õ�c��Cu2+��= =1.1��10-18mol/L�����������ˮŨ��Ҫ��A����Ϊ�˷�ֹ�ȴ������ˮ����������豣��ˮ��Cu2+��Ũ��Լ1.2��10-5mol?L-1��ͨ�������ж��������ˮŨ��Ҫ������ʡ�����ͭ������ˮ���䱥����Һ�ṩ��Cu2+ͭ����Ũ�ȴ����ؽ����Σ�����ˮʱ��ҺŨ�Ȳ����ƣ���B����C��Cu��OH��2��s��?Cu2++2OH-��Ksp��Cu��OH��2��=c��Cu2+��c2��OH-��=2.2��10-20������õ�c��Cu2+��=
=1.1��10-18mol/L�����������ˮŨ��Ҫ��A����Ϊ�˷�ֹ�ȴ������ˮ����������豣��ˮ��Cu2+��Ũ��Լ1.2��10-5mol?L-1��ͨ�������ж��������ˮŨ��Ҫ������ʡ�����ͭ������ˮ���䱥����Һ�ṩ��Cu2+ͭ����Ũ�ȴ����ؽ����Σ�����ˮʱ��ҺŨ�Ȳ����ƣ���B����C��Cu��OH��2��s��?Cu2++2OH-��Ksp��Cu��OH��2��=c��Cu2+��c2��OH-��=2.2��10-20������õ�c��Cu2+��=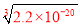 =1.8��10-7mol/L�����������ˮŨ��Ҫ��C����CuCO3��s��?Cu2++CO32-��Ksp��CuCO3��=c��Cu2+��c��CO32-��=1.4��10-10������õ�c��Cu2+��=
=1.8��10-7mol/L�����������ˮŨ��Ҫ��C����CuCO3��s��?Cu2++CO32-��Ksp��CuCO3��=c��Cu2+��c��CO32-��=1.4��10-10������õ�c��Cu2+��= =1.2��10-5mol/L���������ˮŨ��Ҫ��D��ȷ��
=1.2��10-5mol/L���������ˮŨ��Ҫ��D��ȷ��
���㣺�ܶȻ������ļ���


 ��ѧ����ϵ�д�
��ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015���ຣʡ�����и�����ѧ�ڵ�һ���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��ȷ����
A������FeSO4��Һ�м���˫��ˮ: 2Fe2+ + H2O2 + 2H+ =2Fe3+ + 2H2O
B����ⱥ��MgCl2��Һ: 2H2O + 2Cl-  H2��+Cl2��+ 2OH-
H2��+Cl2��+ 2OH-
C����Ca(ClO)2��Һ��ͨ��SO2����: Ca2+ + 2ClO- + H2O + SO2 =CaSO3��+ 2HClO
D����̼�������Һ�м�����������������Һ: Ca2+ + HCO3- + OH-=CaCO3��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015������ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ��װ��������Ӧ������ȷ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015������ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
ij�о�С��Ϊ�ⶨij���̿���MnO2�������������������ϻ��������Ϣ��KMnO4��MnO2�����������¾��ܽ������ƣ�Na2C2O4����������Ӧ���̱�ʾΪ��
2MnO4����5C2O42����16H����2Mn2����10CO2����8H2O��MnO2��C2O42����4H����Mn2����2CO2����2H2O
С���Ա���õζ��ķ����ⶨ���̿���MnO2���������������ʵ�����£�ȷ��ȡ2.20g���̿���Ʒ������2.68g�����ƹ��壬�ټ���������ϡ���Ტ���ȣ����ʲ��μӷ�Ӧ������ַ�Ӧ֮����ȴ����ȥ���ʣ���������Һת�Ƶ�100mL����ƿ�в����ݣ����зֱ�ȡ��20.00mL����Һ������ƿ�У�����0.0200mol��L��1KMnO4����Һ���еζ�����¼���ն������������£�
�ⶨ���� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
��ʼ������mL�� | 0.40 | 0.10 | 0.90 | 0.00 |
���ն�����mL�� | 25.05 | 20.10 | 21.00 | 19.90 |
�Իش��������⣺
��1��0.0200mol��L��1KMnO4����ҺӦ���� ��ѡ���ʽ����ʽ�����ζ����У��ζ��յ�����ж� ��
��2�����ܷ�������о�С��������̿���MnO2���������� ��ѡ��ܡ��������ش��ܡ�������������� ������С�������λ�������ش𡰷���˵��ԭ�� ��
��3������ʵ������д������в��������л�ʹ����MnO2����������ƫС���� ��
A����Һת��������ƿ�У�δ���ձ�������ϴ��
B���ζ�ǰ���첿����һ���ݣ��ζ��յ�ʱ��ʧ
C������ʱ�����ӿ̶���
D���ζ�ǰ���Ӷ������ζ����Ӷ���
E����ƿˮϴ֮��δ�ô���Һ��ϴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015������ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵���������
A�������£��������������Ļ����ҺpH=7����C(Na+)=c(CH3COO-)
B��ij�¶��£�pH=6��NaCl��Һ������Ũ�ȵĴ�С��ϵ��c(Na+)= c(Cl-)>c(H+)>c(OH-)
C����2a mol��L��1HCN��a mol��L��1 NaOH��Һ�������Ϻ�������Һ��c(Na��)>c(CN��)��������ҺpH>7
D����0.1 mol NaHCO3��0.2molNa2CO3�Ļ��Һ�У�c(Na��)��c(H��)��c(OH��)��c(HCO3��)��2c(CO32��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015������ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪ij�¶���ˮ�����ӻ�KW=3.4��10-15.ȡ���¶���Ũ����ͬ��NaOH��HCl��Һ����3��2��������ϣ�������Һ��pH����12����ԭ��Һ��Ũ��Ϊ
A��0.01mol��L��1 B��0.017mol��L��1
C��0.05mol��L��1 D��0.50mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015������ʡ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
��12�֣���1��ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ5�����ʣ� ��
�� ��
�� ��
�� ��
��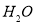 ����÷�Ӧ�л�ԭ������______ ������Ӧ������ת����0.3
����÷�Ӧ�л�ԭ������______ ������Ӧ������ת����0.3 ���ӣ����������������_____
���ӣ����������������_____ ��
��
��2����a mol Cl2 ͨ�뺬b mol FeBr2����Һ�У���0< a / b��1/2 ʱ����Ӧ�����ӷ���ʽΪ��2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ��д����2�����ܷ��������ӷ���ʽ��
�ٵ� a / b =1ʱ____________________________________________ ��
�ڵ�a / b��3/2ʱ____________________________________________ ��
��3���۲����·�Ӧ���ܽ���ɣ�Ȼ������������⣺
��Al(OH)3 ��H2O Al(OH)4�D + H+ ����NH3+H2O
Al(OH)4�D + H+ ����NH3+H2O NH4+ + OH�D
NH4+ + OH�D
��A����֪B(OH)3��һԪ���ᣬ��д������뷽��ʽ��__________________________��
��B��N2H4�Ƕ�Ԫ�����д����ڶ������뷽��ʽ��_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015������ʡ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��150��ʱ��(NH4)2CO3�ֽ�ķ���ʽΪ��(NH4)2CO3 2NH3����H2O����CO2��������ȫ�ֽ⣬��������̬�������ܶ�����ͬ�����������ܶȵ�
2NH3����H2O����CO2��������ȫ�ֽ⣬��������̬�������ܶ�����ͬ�����������ܶȵ�
A��96�� B��48�� C��12�� D��10��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015������ʡ��У������ѧ���ڳ����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ڷ�Ӧ�пɱ��������ԡ���ԭ�ԡ����ԡ����Եȣ����淴Ӧ�Ļ��������У�����ͬһ��Ӧ��ͬʱ�����������ֻ������������ʵ��У� ��
��3FeO+10HNO3==3Fe(NO3)3+NO��+5H2O ��C+2H2SO4(Ũ)==CO2��+2SO2��+2H2O
��8NH3+3Cl2==6NH4Cl+N2 ��NaH+H2O==NaOH+H2�� ��2Na2O2+2H2O==4NaOH+O2��
A�����Т٢� B�����Т٢ۢܢ� C�����Т٢ۢ� D��ȫ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com