
| A. | 离子键是阴阳离子间存在的静电引力 | |
| B. | 失电子难的原子获得电子的能力一定强 | |
| C. | 在化学反应中,某元素由化合态变为游离态,该元素被还原 | |
| D. | 电子层结构相同的不同离子,其半径随核电荷数增多而减小 |
分析 A.离子键为离子的静电作用力;
B、失电子难的原子获得电子的能力不一定强;
C、由元素被还原时元素的化合价变化分析解答;
D、依据离子半径大小的原因分析解答.
解答 解:A.离子键为离子的静电作用力,既有引力也有斥力,故A错误;
B、失电子难的原子获得电子的能力不一定强,如稀有气体原子,故C错误;
C、元素被还原其化合价一定降低,而在化学反应中某元素中由化合态变为游离态,其化合价不一定降低也有可能升高,故在化学反应中某元素中由化合态变为游离态,该元素不一定被还原,故C错误;
D、由于对于原子或离子(相同电子层)来说质子数(核电荷数)越大其原子半径越大,故电子层结构相同的不同离子,其半径随核电荷数增多而减小,故D正确;
故选D.
点评 本题是对微粒结构知识的考查,解题的关键是对微粒结构特点的掌握和理解,比较容易.


科目:高中化学 来源: 题型:选择题
| A. | 华为自主研发的“麒麟”芯片与光导纤维是同种材料 | |
| B. | 研发煤炭的洁净、高效利用技术,保护生态环境 | |
| C. | 聚氯乙烯可作为包装材料,不会造成环境污染 | |
| D. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠和氯化铯晶体中,阳离子的配位数均为6 | |
| B. | 金刚石为三维网状结构,由碳原子以sp3杂化轨道形成共价键 | |
| C. | 金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8 | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)→2H2O(l)+Q1 Q1>QkJ | |
| B. | 1molH2O的键能总和大于1molH2和0.5molO2键能之和 | |
| C. | 2H2(g)+O2(l)→2H2O(g)+Q2,Q2>QkJ | |
| D. | 2molH2O的总能量小于2molH2和1molO2能量之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量,该反应为吸热反应 | |
| B. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| C. | 已知:①2H2(g)+O2(g)=2H2O(g)△H1,②2H2(g)+O2 (g)=2H2O(1)△H2,则△H1<△H2 | |
| D. | 已知:①C(s,石墨)+O2 (g)=CO2(g)△H=-393.5kJ•mol-1, ②C(s,金刚石)+O2(g)=CO2 (g)△H=-395.0 kJ•mol-1则C(s,石墨)=C(s,金刚石)△H=+1.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再充入2molNO2,平衡正向移动,O2的体积分数增大 | |
| B. | 升高温度,O2的体积分数减小 | |
| C. | 充入N2,平衡不移动 | |
| D. | 再充入1molO2,NO2的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 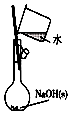 用于配制0.10 mol•L-1 NaOH溶液;评价:正确 | |
| B. |  用于测定中和热;评价:错误,装置中缺少了环形玻璃搅拌棒 | |
| C. | 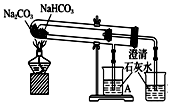 用于比较Na2CO3、NaHCO3的热稳定性;评价:正确 | |
| D. | 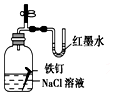 证明铁发生吸氧腐蚀时空气参加反应;评价:正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com