
【题目】如图表示一些晶体中的某些结构,它们分别是NaCl、干冰、金刚石、石墨结构中的某一种的某一部分。
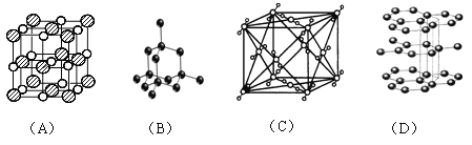
(1)其中代表金刚石的是(填编号字母,下同)_____,金刚石属于_____晶体。
(2)其中代表石墨的是_________,其晶体中碳原子呈平面_________结构排列。
(3)其中代表NaCl的是_________,晶体中Na+与Cl-之间通过__________键结合起来。
(4)代表干冰的是_______,它属于_______晶体,CO2分子间通过_____________结合起来。
(5)上述物质中(A)(B)(C)三者的熔点由高到低的排列顺序为_______________。(填编号字母)
【答案】 B 原子 D 层状 A 离子键 C 分子 范得华力(或分子间作用力) (B)>(A)>(C)
【解析】(1)金刚石是原子晶体,属于正四面体结构,代表金刚石的是B。(2)石墨是层状结构,代表石墨的是D,其晶体中碳原子呈平面层状结构排列。(3)氯化钠是离子晶体,代表NaCl的是A,晶体中Na+与Cl-之间通过离子键结合起来。(4)干冰是固态二氧化碳,属于分子晶体,代表干冰的是C,CO2分子间通过范得华力(或分子间作用力)结合起来。(5)一般情况原子晶体的熔点高于离子晶体,离子晶体高于分子晶体,则上述物质中(A)(B)(C)三者的熔点由高到低的排列顺序为(B)>(A)>(C)。


科目:高中化学 来源: 题型:
【题目】已知有机物A能发生以下转化,并且A可以作为水果的催熟剂,在一定条件下A可以发生自身加成反应,形成高分子化合物E. 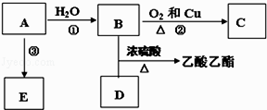
(1)写出E的结构简式 , E(填“能”或“不能”)使酸性KMnO4溶液褪色.
(2)请写出C的名称是 , D分子中的官能团名称是 .
(3)请写出反应②以及B与D发生反应的化学方程式,并注明反应类型: ② , 反应类型;B+D , 反应类型 .
(4)若完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该烃的化学式 , 并写出其所有可能的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
I.将NaOH 溶液与NH4Cl 溶液混合生成NH3·H2O,从而验证NaOH 的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理? 并说明理由:______________________________。
II.根据下图所示装置图回答以下问题。
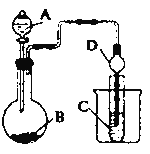
(1)利用如图装置可以验证非金属性的变化规律。干燥管D的作用是___________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:烧瓶中发生反应的离子方程式为_________。装置C中的实验现象为_________。
(3)若要用此装置证明非金属性: N>C>Si,从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液 ②稀醋酸溶液 ③碳酸钙 ④Na2SiO3 溶液 ⑤SiO2
试剂A与C分别为______(填序号)。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是( )
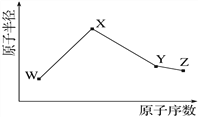
A. 对应简单离子半径:X>W
B. 对应简单气态氢化物的稳定性:Y<Z
C. Y的氧化物能与X的最高价氧化物对应的水化物反应
D. 化合物X2W2既含离子键也含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 1 mol 物质的质量等于该物质的相对分子质量或相对原子质量
B. 摩尔既是物质的量的数量单位,又是物质的量的质量单位
C. 阿伏加德罗常数是12 kg 12C中含有的碳原子数
D. 物质的量是用来描述微观粒子的物理量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+ , 发现和探究过程如下.
向硝酸酸化的0.05molL﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)检验产物
①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有 .
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+ , 乙认为铁粉过量时不可能有Fe3+ , 乙依据的原理是(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量小;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅 |
(资料:Ag+与SCN﹣生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2 , 由于(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;
假设d:根据现象,判断溶液中存在Ag+ , 可产生Fe3+ .
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是 , 操作现象是 . 
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗疟疾药物青蒿素可由香茅醛为原料合成.下列有关香茅醛的叙述错误的是( ) 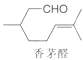
A.分子式是C10H18O
B.至少有六个碳原子处于同一平面
C.能与新制Cu(OH)2悬浊液反应
D.能与H2或Br2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com