
(1)Na2CO3固体中混有少量NaHCO3固体,除去的方法是 ,化学方程式为 .
(2)NaHCO3溶液中混有少量Na2CO3,除去的方法是 ,反应的离子方程式为 .
(3)NaOH溶液中混有少量Na2CO3,除去的方法是 ,反应的离子方程式为 .
(4)CO2中混有少量的SO2,除去的方法是 ,反应的化学方程式为 .
| 物质的分离、提纯的基本方法选择与应用;化学方程式的书写.. | |
| 专题: | 化学实验基本操作. |
| 分析: | (1)NaHCO3不稳定,可用加热的方法除去; (2)Na2CO3溶液可与二氧化碳反应生成NaHCO3; (3)可加入氢氧化钙除杂; (4)可用饱和碳酸氢钠溶液除杂. |
| 解答: | 解:(1)NaHCO3不稳定,可用加热的方法除去,方程式为2NaHCO3 (2)NaHCO3溶液中混有少量Na2CO3,除去杂质可用通入过量CO2的方法,反应的离子方程式为CO32﹣+H2O+CO2═2HCO3﹣, 故答案为:在溶液中通入过量CO2;CO32﹣+H2O+CO2═2HCO3﹣; (3)除去NaOH溶液中混有的少量Na2CO3,所用试剂为Ca(OH)2,反应的离子方程式为CO32﹣+Ca2+=CaCO3↓, 故答案为:滴入适量的Ca(OH)2溶液;CO32﹣+Ca2+=CaCO3↓; (4)可用饱和碳酸氢钠溶液除杂,方程式为SO2+2NaHCO3═Na2SO3+H2O+2CO2,故答案为:将混合气体通入饱和的NaHCO3溶液;SO2+2NaHCO3═Na2SO3+H2O+2CO2. |
| 点评: | 本题综合考查物质的分离提纯,为高频考点,侧重于物质的性质的考查,注意把握离子方程式的书写,难度不大. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某溶液中加入铝粉能产生氢气,在该溶液中一定能大量共存的离子组是( )
A.Na+、K+、Cl-、SO B.Cu2+、Fe2+、NO
B.Cu2+、Fe2+、NO 、SO
、SO
C.Na+、Ca2+、Cl-、ClO- D.K+、NH 、Cl-、SO
、Cl-、SO
查看答案和解析>>
科目:高中化学 来源: 题型:
为确定某溶液的离子组成,进行如下实验:①测定溶液的pH,溶液显强碱性;②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的气体;③在②中溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;④取③中上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验现象,以下推测正确的是( )
A.一定有SO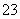
B.一定有CO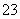
C.一定有Cl-
D.不能确定HCO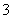 是否存在
是否存在
查看答案和解析>>
科目:高中化学 来源: 题型:
相同条件下,O4是意大利的一位科学家合成的一种新型的氧分子,一个分子由四个氧原子构成,振荡会发生爆炸,在相同条件下,关于等质量的O4和O3比较正确的是( )
|
| A. | 所含原子数相等 | B. | 密度之比1:1 | C. | 体积之比1:1 | D. | 分子数之比4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中正确的是( )
|
| A. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH﹣→NH3↑+2H2O |
|
| B. | 向FeBr2溶液中通入Cl2,当n(FeBr2)=n(Cl2)时:2Fe2++4Br﹣+3Cl2→2Fe3++2Br2+6Cl﹣ |
|
| C. | 向FeI2溶液中通入Cl2,当n(FeI2):n(Cl2)=1:1时:2I﹣+Cl2→I2+2Cl﹣ |
|
| D. | 向烧碱溶液中通入CO2,当n(NaOH):n(CO2)=3:2时:OH﹣+CO2→HCO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在实验室用如图所示装置探究氮氧化物气体与烧碱溶液的反应。实验过程中将胶头滴管中的液体挤入烧瓶,若碱液可快速、充分吸收产生的氮氧化物气体。下列叙述正确的是( )
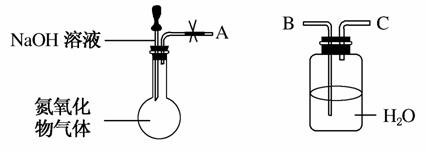
A.若将A与B连接,打开止水夹,则广口瓶中长导管口有气泡产生
B.若将A与C连接,打开止水夹,水沿导管由广口瓶进入烧瓶中
C.无论A连接B还是C,打开止水夹,均无明显现象
D.若将NaOH溶液换为水,可以用这套装置验证氨气易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3===FeCO3↓+Na2SO4
FeCO3+C6H8O7===FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
(1)制备FeCO3时,选用的加料方式是________(填字母,)原因是________________________________________________________________________。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是________________________________________________________________________________________________________________________________________________。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80 ℃下搅拌反应。
①铁粉的作用是______________________________________________ _____________________。
②反应结束后,无需过滤,除去过量铁粉的方法是________________________________________________________________________________________________________________________________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是________________________________________________________________________。
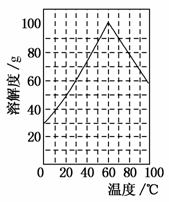
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合上图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,__________________________________________________________________________________________________________________________________,得到FeSO4溶液,_________________________________ _____________________________________________,得到FeSO4·7H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
氡是放射性稀有气体元素,氡气吸入体内有害健康,氡的核电荷数是86,相对原子质量是222。科学家还发现某些放射性矿物分解放出的“锕射气”,是由质子数86,质量数219的原子组成,下列有关氡的说法正确的是
A.氡气在标准状况下密度约是19.82g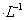
B.氡气化学性质较活泼,因此对人体有害
C.氡原子核外有7个电子层,最外层有8个电子
D.“锕射气”是氡的同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.蔗糖、麦芽糖水解都能得到2种物质
B.纤维素、淀粉和蛋白质都是高分子化合物
C.石油分馏可获得乙烯、丙烯和丁二烯
D.酯类和糖类均能发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com