
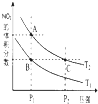
 氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.| 7 |
| 8 |
| c2(NH3) |
| c(N2)c2(H2) |
| c2(NH3) |
| c(N2)c2(H2) |
| 7 |
| 8 |
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| amol/L×10-7mol/L |
| VL×c(NH3?H2O)mol/L |
| a |
| 200V |
| a |
| 200V |


科目:高中化学 来源: 题型:
| A、该溶液的pH小于7 |
| B、c(CH3COOH)+c(CH3COO-)=0.20mol?L-1 |
| C、c(CH3COOH)<c(CH3COO-) |
| D、c(CH3COO-)+c(OH-)=0.10mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取11.7g食盐 |
| B、用量筒量取12.36ml盐酸 |
| C、用酸式滴定管量取21.20ml 0.10mol/L H2SO4溶液 |
| D、用200ml容量瓶配制500ml 0.1mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体的体积 |
| B、相同温度下,0.2mol?L-1醋酸溶液和0.1mol?L-1醋酸溶液中的c(H+) |
| C、在0.1mol?L-1NaHSO4溶液中,阳离子数与阴离子数 |
| D、在FeCl2溶液中,c(Cl-)与c(Fe2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液中:K+、H+、SO42-、MnO4- |
| B、c(H+):c(OH-)=10-10的溶液中:K+、Na+、CO32-、AlO2- |
| C、c(H+):c(OH-)=1溶液中:K+、Na+、NO3-、ClO- |
| D、能使pH试纸变蓝色的溶液中:Ca2+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、α3>α4>α2=α1 |
| B、α4>α3>α2=α1 |
| C、c(NO3-)>c(NH4+)>c(OH-)>c(H+) |
| D、c(NO3-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
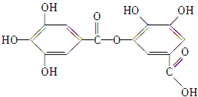
| A、它有酸性,能与纯碱溶液反应 |
| B、可以水解,其水解产物只有一种 |
| C、1 mol该有机物最多能与7 mol NaOH反应 |
| D、该有机物能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大 | B、减少 |
| C、不变 | D、可能增大也可能减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com