
| A.阴极自始自终只析出H2 | B.阳极先析出Cl2,后析出O2 |
| C.电解最后阶段为电解水 | D.溶液PH值不断增大,最后为7 |


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源:不详 题型:单选题
A.电路中通过电子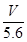 mol mol | B.n= |
C.溶液中H+增加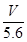 mol mol | D.n=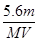 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
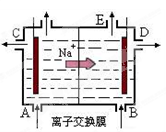
| A.从E口逸出的气体是H2 |
| B.从B口加入含少量NaOH的水溶液以增强导电性 |
| C.标准状况下每生成22.4 LCl2,便产生2 mol NaOH |
| D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铜片,石墨棒,稀硫酸 | B.铜片,石墨棒,硝酸银溶液 |
| C.锌片,铜片,稀盐酸 | D.铜片,银片,FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2I--2e-=I2碘遇淀粉变蓝 |
| B.Cu-2e-=Cu2+Cu2+显蓝色 |
| C.2Cu+4I--4e-=2CuI↓+I2碘遇淀粉变蓝 |
| D.4OH――4e-=2H2O+O2O2将I-氧化为I2,碘遇淀粉变蓝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 阳极 | 阴极 | 溶液甲 | 物质乙 |
| A. | Pt | Pt | NaOH | NaOH固体 |
| B. | Pt | Pt | H2SO4 | H2O |
| C. | C | Fe | NaCl | 盐酸 |
| D. | 粗铜 | 精铜 | CuSO4 | Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑤ | B.③④⑥⑦ | C.④⑥⑦ | D.③⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com