
 HCl+ HClO;
HCl+ HClO;

科目:高中化学 来源:不详 题型:填空题
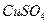 溶液;
溶液;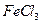 饱和溶液,可以制得
饱和溶液,可以制得 胶体;
胶体; 步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

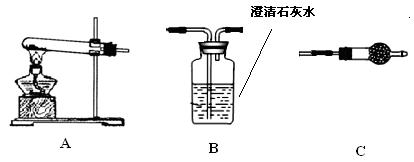
| A.瓶中盛满水,从B口进气,用排水法收集NO2 |
| B.瓶中盛适量浓硫酸,从A口进气来干燥NH3 |
| C.从B口进气,用排空气法收集CO2 |
| D.瓶中装满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 (B)
(B)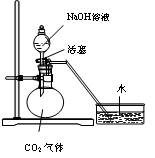
 (D)
(D)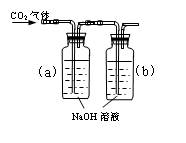

| 装置 | 实验方法 | 实验现象 |
| | | |
| | | |
| | | |
| | | |
| | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体 |
| B.测定工业烧碱的含量(含杂质碳酸钠)可称取一定量样品放人锥形瓶中,加适量水溶解,再加入稍过量氯化钡溶液,用酚酞作指示剂,用标准浓度的盐酸滴定 |
| C.用分液漏斗分离苯与硝基苯 |
| D.除去氯化铁酸性溶液中的氯化亚铁:加入适量的硝酸溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入AgNO3溶液,有白色沉淀生成,则证明含有Cl- |
| B.加入BaCl2溶液,产生白色沉淀,则证明有SO42- |
| C.加入盐酸,放出能使澄清石灰水变浑浊的气体,则证明有CO32- |
| D.加浓NaOH溶液后加热,有使湿润的红色石蕊试纸变蓝的气体产生,则证明有NH4+ |
查看答案和解析>>
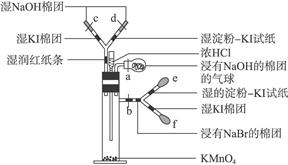
科目:高中化学 来源:不详 题型:填空题


















 (1)各装置连接顺序为 。
(1)各装置连接顺序为 。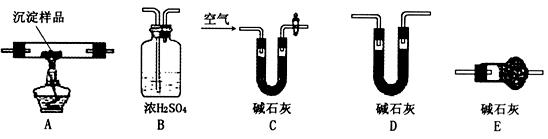
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.实验目的:定量测定化学反应速率 |
| B.实验原理:利用氧化还原反应原理,用酸性高锰酸钾溶液滴定亚硫酸钠溶液,测定亚硫酸钠溶液的浓度 |
| C.实验过程中某步骤:将0.1mol/L50mLNaOH溶液逐滴加入到0.1mol/L55mL盐酸溶液中 |
| D.加热烧杯,分离SiO2和NH4Cl的现象:烧杯底部有白色固体出现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com