
【题目】下列过程一定释放能量的是( )
A.化合反应
B.分解反应
C.分子拆成原子
D.原子组成分子
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的分离或提纯的说法中正确的是
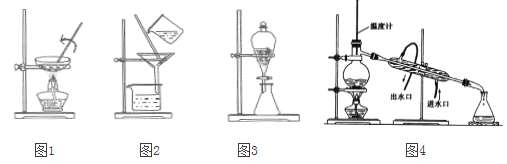
A. 图1:从FeCl2溶液中制取FeCl2晶体B. 图2:过滤NaCl溶液中MgSO4
C. 图3:用CCl4萃取,从溴水中得到纯溴D. 图4:用蒸馏的方法分离酒精和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
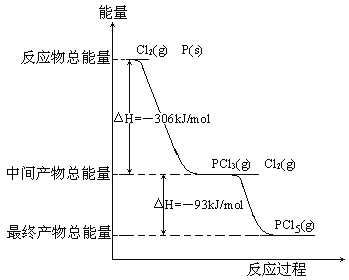
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式_________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式_________________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2_______α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是________________________________________。
(4)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于新材料及3D打印技术,科学家研制出一种微胶囊吸收剂能将工厂排放的CO2以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充入Na2CO3溶液,其原理如图所示。
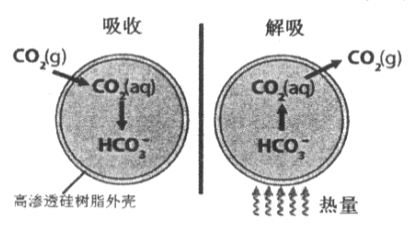
(1)这种微胶囊吸收CO2的原理是________(用离子方程式解释),此过程是____(填“吸收”或“放出”)能量的过程。
(2)在吸收过程中关于胶囊内溶液下列说法正确的是_____________。
a. 吸收前溶液中c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
b. 吸收过程中,体系中的含碳微粒只有CO32-、HCO3-、H2CO3
c. 当n(CO2):n(Na2CO3)=1:3时,溶液中c(CO32-)<c(HCO3-)
d. 溶液中始终有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
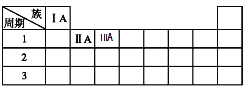
(3)下表为元素周期表的一部分,请将Na、C元素填在表中对应的位置上______________。
(4)生活中,经常用热的碳酸钠溶液清洗油污,结合化学用语,用必要的文字说明原因______________________。
(5)太阳能热电化学(STEP)生产水泥法可使二氧化碳排放量完全为零。基本原理如下图所示。利用熔融的碳酸钠为电解质,碳酸钙先分解成为CaO和CO2。最后得到石灰(CaO)、碳和氧气。
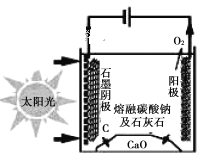
石墨电极上的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氨气通常有两种方法:
①用固体氢氧化钙与氯化铵共热;
②在常温下用固体氢氧化钠与浓氨水反应。
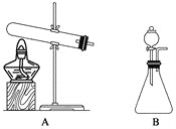
(1)上面的制取装置图中,方法①应选用装置__________(填“A”或“B”,下同);方法②应选用装置__________。
(2)加热氯化铵与氢氧化钙混合物制取氨气的反应方程式是________________。
(3)在制取后,如果要干燥氨气,应选用的干燥剂是________________(填字母)。
A.浓硫酸 B.碱石灰 C.五氧化二磷
(4)检验集气瓶中是否收集满氨气的方法是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,炽热的铁与水蒸气在一个体积可变的密闭容器中进行反应:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),下列条件的改变对反应速率几乎无影响的是
Fe3O4(s)+4H2(g),下列条件的改变对反应速率几乎无影响的是
A. 把铁块换成铁粉 B. 将容器的体积压缩至原体积的一半
C. 压强不变,充入氮气使容器体积增大 D. 体积不变,充入氮气使容器压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置制取少量溴苯,请回答下列问题:

(1)写出实验室制取溴苯的化学方程式__________。
(2)上述反应发生后,在锥形瓶中加入硝酸银溶液观察到的现象是________,你认为这一现象能否说明溴和苯发生了取代反应(填“能”或“不能”)____________,理由是______________________。
(3)该装置中长直导管a的作用________,锥形瓶中的导管为什么不插入液面下?________。
(4)反应后得到的溴苯中溶有少量苯、溴、二溴苯、溴化铁和溴化氢等杂质,欲除去上述杂质得到比较纯净的溴苯,合理的操作步骤是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 ℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,Ⅰ容器0.1mol N2O4 Ⅱ容器0.2 mol NO2,发生反应:2NO2(g) ![]() N2O4(g) ΔH<0,下列说法正确的是( )
N2O4(g) ΔH<0,下列说法正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4) +α(NO2)=1
B. 平衡后,再向Ⅱ容器内通入一定量的NO2,又达到平衡时,NO2的体积分数增大
C. 若只改变一个条件使Ⅱ容器NO2的平衡转化率增大,则该反应的化学平衡常数一定变大
D. 平衡后,反应放出或吸收热量的数值Q:Q(Ⅰ) =Q(Ⅱ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com