
| A. | 通常状况下,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ•mol-1 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
B.液态氟化氢的能量比气态氟化氢的能量低,根据反应热与能量关系判断;
C.该反应为可逆反应,0.5mol氮气和,1.5mol氢气完全反应生成的氨气小于1mol,即生成1mol氨气放出的热量大于19.3kJ;
D.依据热化学方程式和盖斯定律计算分析判断.
解答 解:A.燃烧热是1mol可燃物完全燃烧生成温度氧化物时放出的热量;常温常压下,1g氢气充分燃烧生成液态水,放出142.9 kJ热量.则表示氢气燃烧热的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.5kJ/mol,故A错误;
B.液态氟化氢的能量比气态氟化氢的能量低,根据能量守恒,1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量大于270kJ,故B错误;
C.合成氨的反应为可逆反应,0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g)的物质的量小于1mol,所以生成2mol氨气放出的热量大于放热19.3kJ×2=38.6kJ,故C错误;
D.①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ/mol,
②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ/mol,
则依据盖斯定律②-①得到C(s,金刚石)═C(s,石墨),△H=-1.5kJ/mol;故D正确;
故选D.
点评 本题考查学生对热化学方程式的理解、反应热与能量关系、盖斯定律的应用,题目难度中等,注意燃烧热的定义即1mol可燃物完全燃烧生成稳定氧化物时放出的热量;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 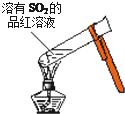 加热后溶液颜色变为无色 | B. |  配制100mL0.10mol•L-1NaCl溶液 | ||
| C. | 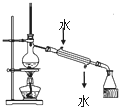 实验室用该装置制取少量蒸馏水 | D. |  称量25gNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
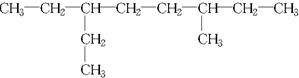
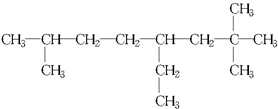
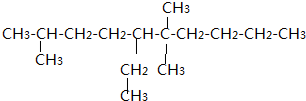 .
.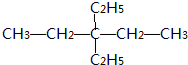 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2+O2=2H2O△H=+285.8 kJ•mol-1 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨不及金刚石稳定 | |
| C. | 在稀溶液中:H++OH-=H2O△H=-57.3 kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+(2×283.0 )kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学变化都伴随着能量变化 | |
| B. | 任何反应中的能量变化都表现为热量变化 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 热化学方程式的计量数可以表示分子的个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
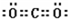 共价键;
共价键;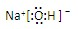 ,离子键,共价键;
,离子键,共价键; ,共价键;
,共价键;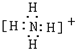 ,共价键.
,共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com