
| A.ΔH1>ΔH2>ΔH3 | B.ΔH2>ΔH3>ΔH1 | C.ΔH2>ΔH1>ΔH3 | D.ΔH3>ΔH2>ΔH1 |
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:不详 题型:单选题
| A.Q1+ Q2+Q3 | B.0.5(Q1+Q2+Q3 ) |
| C.0.5 Q1-1.5 Q2+0.5Q3 | D.1.5 Q1-0.5 Q2+0.5Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1②
O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1②| A.+1 164.1 kJ·mol-1 | B.-1 641.0 kJ·mol-1 |
| C.-259.7 kJ·mol-1 | D.-519.4 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
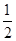 O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
| A.升高温度 | B.充入He(g)使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1 mol CO2和3 mol H2 |
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
 ,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g)
2SO3(g) 

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-260.4 kJ·mol-1 | B.+260.4 kJ·mol-1 |
| C.-611.5 kJ·mol-1 | D.+520.8 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com