
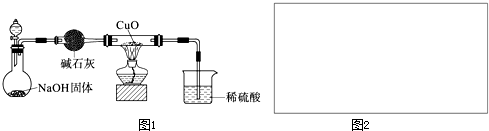
 装置代替,故答案为:
装置代替,故答案为: ;
;

 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
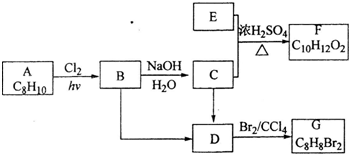
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 1 | 1 | a | 1 |
| A、阴极析出的金属是铜与铝 |
| B、a=3 |
| C、阳极生成1.5 mol Cl2 |
| D、电解后溶液的pH=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
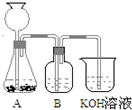 KOH是一种重要的化工原料,广泛应用于K2CO3的生产.某研究性学习小组设计了两套实验方案进行实验:
KOH是一种重要的化工原料,广泛应用于K2CO3的生产.某研究性学习小组设计了两套实验方案进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| O3/Zn+H2O |
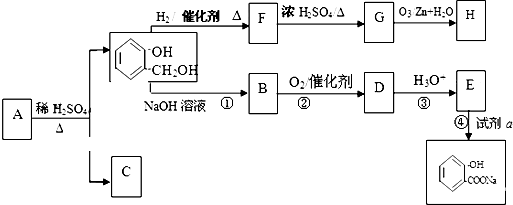
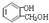 与饱和溴水反应的化学方程式
与饱和溴水反应的化学方程式 反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论为
反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论为查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
| A、Q2=98.5 kJ |
| B、2SO2(g)+O2(g)?2SO3(s);△H>-197KJ/mol |
| C、丙容器中压强大于乙,所以丙的反应速率大于乙 |
| D、2Q3<Q1<197KJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com