
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )
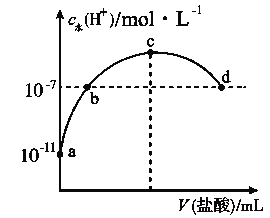
A. 常温下,0.1 mol·L-1氨水中![]() 的电离常数
的电离常数![]() 约为
约为![]()
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)<c(Cl-)
D. b点代表溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨晶体晶胞的结构模型如下图所示。实验测得金属钨的密度为19.30![]() 已知钨的相对原子质量为183.8。回答下列问题:
已知钨的相对原子质量为183.8。回答下列问题:
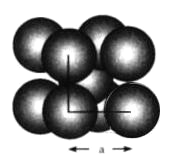
(1)在钨晶体中每个晶胞占有的钨原子数为__________个。
(2)钨晶体晶胞的边长为![]() __________
__________![]() 。
。
(3)钨原子的半径为__________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“试剂”和“烧杯中的物质”不能完成“实验目的”的是


实验目的 | 试剂 | 烧杯中的物质 | |
A | 醋酸的酸性强于苯酚 | 碳酸氢钠溶液 | ①醋酸 ②苯酚溶液 |
B | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯 ②苯酚溶液 |
C | 甲基对苯环的活性有影响 | 酸性高锰酸钾溶液 | ①苯 ②甲苯 |
D | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 | 金属钠 | ①水 ②乙醇 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为_____________。
(2)由A、B、W三种元素组成的18电子微粒的电子式为______________。
(3)若要比较D与E的金属性强弱,下列实验方法可行的是____________。
A. 将单质D置于E的盐溶液中,若D不能置换出单质E,说明D的金属性弱
B. 比较D和E的最高价氧化物对应水化物的碱性,前者比后者强,故前者金属性强
C. 将D、E的单质分别投入到同浓度的盐酸中,观察到D反应更剧烈,说明D的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】EPR橡胶(![]() )和PC塑料(
)和PC塑料( )的合成路线如下:
)的合成路线如下:

(1)A的名称是 ___________。
(2)C的结构简式____________。
(3)下列说法正确的是(选填字母)_______________。
A. 反应Ⅱ的原子利用率为100%
B. 反应Ⅲ为取代反应
C. 1 mol E与足量金属 Na 反应,最多可生成标准状况下22.4 L H2
D. CH3OH在合成PC塑料的过程中可以循环利用
(4)反应Ⅰ的化学方程式是_______________________________。
(5)反应Ⅳ的化学方程式是_______________________________。
(6)已知:

以D和乙酸为起始原料合成![]() 无机试剂任选,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)。______________
无机试剂任选,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性溶液中分解产生S、SO2。
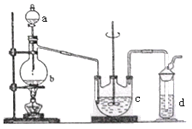
Ⅰ. Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得,实验室模拟该工业过程的装置如图所示。
(1)b中反应的离子方程式为________,c中试剂为_________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是_______。
(3)实验中要控制SO2生成速率,可以采取的措施有___________(写出两条)。
(4)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_______。
(5)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:___________________________________。
Ⅱ. 探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)
Fe(S2O3)33-(紫黑色)
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O32-
装置 | 编号 | 试剂X | 实验现象 |
| ① | Fe(NO3)3溶液 | 混合后溶液先变成紫黑色, 30s后溶液几乎变为无色 |
② | AgNO3溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
(6)根据实验①的现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过____(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅰ的现象:____。
(7)同浓度氧化性:Ag+ > Fe3+。实验②中Ag+未发生氧化还原反应的原因是____。
(8)进一步探究Ag+和S2O32-反应。
装置 | 编号 | 试剂X | 实验现象 |
| ③ | AgNO3溶液 | 先生成白色絮状沉淀,沉淀很快变为黄色、棕色,最后为黑色沉淀。 |
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数:Ag2S2O3+_____ =Ag2S+_____
(9)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和____有关(写出两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法不正确的是

A. b点对应的Ksp等于c点对应的Ksp
B. 采取蒸发溶剂的方法可以使溶液从a点变到b点
C. 该温度下,Ag2SO4的Ksp=1.6×10-5
D. 0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于ds区的元素是________(填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状物结构简式为________。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子数为________。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:_______________________。
(5)画出⑨的外围电子排布图____________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com