
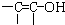 结构的物质)
结构的物质) ,故答案为:CH3CHO或
,故答案为:CH3CHO或 ;
; | 催化剂 |
| △ |
| 催化剂 |
| △ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| B、取a克混合物与足量稀硫酸充分反应,逸出气体未经干燥用碱石灰吸收,增重b克 |
| C、取a克混合物充分加热至恒重,减重b克 |
| D、取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com