
| X | Y | |
| Z | W |
| A. | 最高正化合价:X=W>Y>Z | |
| B. | 原子半径:W>Z>Y>X | |
| C. | 最高价氧化物对应水化物的酸性:Z<X<W<Y | |
| D. | 最高价含氧酸的钠盐溶液能与SO2反应的:X、Y、Z、W |
分析 W是组成信息高速公路骨架的元素之一,应为Si元素,根据X、Y、Z、W在元素周期表中的位置可知X为C元素,Y为N元素,Z为Al元素,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:由以上分析可知X为C元素,Y为N元素,Z为Al元素,W为Si元素,
A.C、Si的最高正价为+4,而Y为N,最高化合价为+5价,故A错误;
B.同周期元素从左到右原子半径逐渐减小,则X>Y、Z>W,故B错误;
C.非金属性N>C>Si>Al,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,故C错误;
D.最高价含氧酸的钠盐分别为Na2CO3、NaNO3、NaAlO2、Na2SiO3,由于亚硫酸酸性比碳酸、硅酸强,则二氧化硫可与Na2CO3、Na2SiO3溶液反应生成二氧化碳、硅酸,NaAlO2溶液与二氧化硫反应生成氢氧化铝沉淀,二氧化硫水溶液呈酸性,而硝酸根离子在酸性条件下具有强氧化性,则NaNO3可与二氧化硫在溶液中发生氧化还原反应,故D正确.
故选D.
点评 本题考查位置、结构、性质的关系及应用,把握元素在周期表中的位置及元素周期律为解答的关键,注意利用实例分析,侧重分析能力和归纳能力的考查,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 浓度均为0.1 mol•L-1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者 | |
| B. | 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 | |
| C. | 0.2 mol•L-1 HCOOH 与 0.1 mol•L-1 NaOH 等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+) | |
| D. | 0.2 mol•L-1 CH3COONa 与 0.1 mol•L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
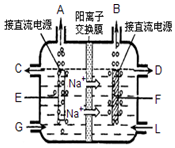 食盐是日常生活必需品,也是重要的化工原料.
食盐是日常生活必需品,也是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
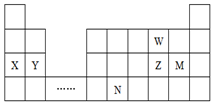
| A. | 原子半径:Y>Z>W,简单离子半径:M->Z2->W2- | |
| B. | 单质的还原性:X>Y,简单氢化物的沸点:Z>W | |
| C. | 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N的单质可作 半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
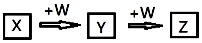 X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如图转化关系(其它产物已略去):下列说法不正确的是( )
X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如图转化关系(其它产物已略去):下列说法不正确的是( )| A. | 若W是强氧化性的单质,则X可能是金属铝 | |
| B. | 若W是氢氧化钠,则X水溶液为酸性 | |
| C. | 若W是单质铁,则Z溶液可能是FeCl2溶液 | |
| D. | 若W是氧气,则X、Z的相对分子质量可能相差48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
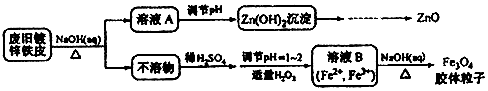
| A. | 用NaOH溶液处理废旧镀锌铁皮的作用是去除油污、溶解镀锌层 | |
| B. | 调节溶液A的pH产生Zn(OH)2沉淀,经抽滤、洗涤、灼烧即可制得ZnO | |
| C. | 由溶液B制得Fe3O4胶体粒子的过程中,须持续通N2,其原因是防止Fe2+被氧化 | |
| D. | Fe3O4胶体粒子能用减压过滤法实现固液分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H2>0 | |
| B. | B为H2和O2制备H2O2的催化剂 | |
| C. | 反应①的正反应的活化能大于逆反应的活化能 | |
| D. | H2(g)+O2(g)?H2O2(1)的△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com