
����Ŀ��������һ����Ҫ�Ļ�����Ʒ��Ŀǰ��Ҫ���á��Ӵ������������������ж��ڷ�Ӧ 2SO2+O2 ![]() 2SO3��˵������ȷ����( )
2SO3��˵������ȷ����( )
A. ֻҪѡ�����˵�������SO2��O2����ȫ��ת��ΪSO3
B. �ڹ�ҵ�ϳ�SO3ʱ��Ҫͬʱ���Ƿ�Ӧ���ʺͷ�Ӧ�ܴﵽ���������������
C. �÷�Ӧ�ﵽƽ���Ӧ����ȫֹͣ�ˣ������淴Ӧ���ʾ�Ϊ��
D. �ڴﵽƽ�����ϵ�У�������18Oԭ����ɵ�O2��18O��������SO2��SO3��
���𰸡�B
��������A��SO2��O2��Ӧ����SO3���ڿ��淴Ӧ�����淴Ӧ�������ʱ����Ӧ�ﵽ����ȣ�����ѧƽ��״̬�����Է�Ӧ�ﲻ��ȫ��ת��Ϊ�������A����B��SO2��O2��Ӧ����SO3���ڿ��淴Ӧ���ڹ�ҵ�ϳ�SO3ʱ����Ҫ���Ƿ�Ӧʱ����Ҫ����ת���ʣ���Ҫͬʱ���Ƿ�Ӧ���ʺͷ�Ӧ�ܴﵽ��������������⣬��B��ȷ��C�����淴Ӧ�ﵽƽ������淴Ӧ��������Ҳ�����0�����淴Ӧ�ﵽһ����̬ƽ��״̬���Ƿ�Ӧֹͣ����C���� D�����ڷ�ӦΪ���淴Ӧ���ڴﵽƽ�����ϵ�У�������18Oԭ����ɵ�O2��SO2��SO3��18O������O2��SO2��SO3�У���D����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Щ�������ڻ�״̬�¿��Ե����� ��
A��HCl B��NH4Cl C��NaHSO4 D��H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ϳɾ������½ṹ��������
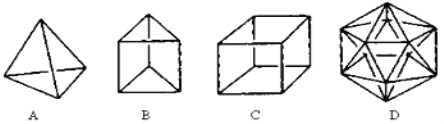
��1���ṹD��Ȼ�Dz����ܺϳɵģ�ԭ���� ��
��2���ڽṹA��ÿ����̼ԭ��֮�����һ��CH2ԭ���ţ������γɽ���顣������ķ���ʽΪ ��
��3��A��һ����״����ͬ���칹�������������Ȳ�ۺϵõ��������״���Ľṹ��ʽΪ ��
��4��B��һ��ͬ���칹������ķ���������֤���÷������е�̼̼�����ǵ�˫���������е���ʵ�� ��
a�����Ķ�λ��Ԫȡ����ֻ��һ��
b��������λ��Ԫȡ����ֻ��һ��
c������������̼̼���ļ��������
d���ܷ���ȡ����Ӧ�ͼӳɷ�Ӧ
��5��C��һ�������¿ɷ���±����Ӧ����C�����ȴ��ﹲ�� ��ͬ���칹�塣
��6��C��һ�����ڷ�������ͬ���칹��������ij�����ϵĵ��壬��÷��������ӷ����Ӿ۷�Ӧ�Ļ�ѧ����ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��G����Ԫ�ط������������ڣ���ԭ��������������X��Zͬ��
�壬���γ����ӻ�����ZX,Y��Mͬ���壬���γ�MY2��MY3���ַ��ӡ���ش��������⣺
(1)Y��Ԫ�����ڱ��е�λ��Ϊ ��
(2)����Ԫ�ص�����������Ӧ��ˮ����������ǿ���� ��д��ѧʽ����
�ǽ�����̬�⻯�ﻹԭ����ǿ���� ��д��ѧʽ����
(3)X2M��ȼ������H��-a kJ��mol-1��д��X2Mȼ�շ�Ӧ���Ȼ�ѧ����ʽ�� ��
(4)ZX�ĵ���ʽΪ ��ZX��ˮ��Ӧ�ų�����Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�ȼ�ϵ�����С���ྻ���������������ȸߣ����ڱ�ЯʽͨѶ�豸������������Ӧ�á�ij�״�ȼ�ϵ�ص��ܷ�Ӧʽ2CH4O + 3O2= 2CO2+ 4H2O����ͼ�Ǹ�ȼ�ϵ�ص�ʾ��ͼ������˵����ȷ����

A. a�Ǽ״�ȼ�ϡ�b������
B. ��ת��6mole-ʱ������33.6LO2
C. ������Ӧ��CH4O - 6e-+ H2O = CO2��+ 6H+
D. ���Ӵ�N�缫����������Ĥ����M�缫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Al��OH��3��H2SO4����ҵ��NH4��2SO4����FeSO4��Ϊԭ���Ʊ����������մɵĹ�����������ͼ��ʾ��

�ش��������⣺
��1�����������з�������Ҫ��Ӧ�����ӷ���ʽΪ________________��
��2����25��ʱ��Kw=1.0��10-14��Kb��NH3��H2O��=1.75��105����NH4��2SO4��Һ�����ԣ���ԭ���ǣ���������ʽ���ͣ���__________�������ӷ���ʽ��ƽ�ⳣ��KԼΪ______����������֣���
��3����μ����к�Һ�е�������������ȫ����_________��
��4��NH4Al(SO4)2��Һ�����NaOH��Һ��ϼ��ȣ���Ӧ�Ļ�ѧ����ʽΪ__________��
��5�����Ϸ���������ͼ��M����Ҫ�ɷֵĻ�ѧʽΪ________��M����һ������������ʵ��ѭ�����ã������ʵ�������_________��
��6������NH4Al(SO4)2��12H2O�ڼ���ʱ��������������¶ȵı仯��ͼ��ʾ��633��ʱʣ�����ɷֵĻ�ѧʽΪ_____________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ����٤����������ֵ������˵����ȷ����
A. ������7.2gCaO2�����������Ӻ�����������Ϊ0.3NA
B. 1mol/L���Ȼ�����Һ�У���CI-����ĿΪ3NA����Fe3+����ĿΪNA
C. ��Ӧ3H2��g��+N2��g��2NH3��g�� ��H=-92KJ/mol�����ų�����9.2KJʱ��ת�Ƶ���0.6NA
D. ��״���£�11.2L���ȼ����к��к����Թ��ۼ���ĿΪ1.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L 1mol/L�İ�ˮ�У������й�˵����ȷ����
A��NH3��H2OΪ1mol ����������Ϊ35g
B��NH4+Ϊ1mol ����������Ϊ18g
C���ܽ�״̬��NH3����Ϊ1mol����������Ϊ17g
D����ˮ��NH3��NH3��H2O��NH4+�������ܵ����ʵ���Ϊ1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��ԭ��������������Ķ�����Ԫ�أ��һ���ͬ�壻����ֻ������Ϊ������Xԭ�ӵ�����������������������ȣ�X��W��Y��Z������ԭ�ӵ�����������֮�;�Ϊ9������Y��W������Ũ��NaOH��Һ��Ӧ����ش��������⣺
��1��Y��Z��W��ԭ�Ӱ뾶��С�����˳�� ��
��2��ZW2�ĵ���ʽ�� ��
��3��ʵ�����Ʊ�Y������������ˮ��������ӷ���ʽ��
��4��X��Y��ѧ�������ƣ���X��Ũ��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��
��5��0.1mol�ĵ���W��50mL 1.5mol/L��FeBr2��Һ��Ӧ����������Fe2+��Br�������ʵ���֮���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com