
| A£® | ¢Ś¢Ū¢Ü¢Ż | B£® | ¢Ū¢Ż¢Ž | C£® | ¢Ł¢Ś¢Ū¢Ü¢Ż | D£® | ¢Ł¢Ś¢Ü¢Ž |
·ÖĪö ¢ŁĀČ»ÆĀĮĖ®½āÉś³ÉĒāŃõ»ÆĀĮŗĶĀČ»ÆĒā£¬¼ÓČČ“Ł½ųĀČ»ÆĒā»Ó·¢£¬“Ó¶ų“Ł½ųĀČ»ÆĀĮĖ®½ā£¬½«ČÜŅŗÕōøɵƵ½ĒāŃõ»ÆĀĮ¹ĢĢ壬ĮņĖįĀĮĖ®½āÉś³ÉĒāŃõ»ÆĀĮŗĶĮņĖį£¬µ±ČÜŅŗÕōøÉŹ±£¬µĆµ½µÄ¹ĢĢåŹĒĮņĖįĀĮ£»
¢ŚÅäÖĘFeCl3ČÜŅŗŹ±£¬½«FeCl3¹ĢĢåČܽāŌŚŃĪĖįÖŠŅÖÖĘĢśĄė×ÓĖ®½ā£¬ĮņĖįČÜŅŗÖŠŅżČėĮņĖįøłĄė×Ó£»
¢Ū·ś»Æļ§ČÜŅŗÖŠĖ®½āÉś³ÉĒā·śĖį£»
¢ÜÅŻÄĆš»šĘ÷ÖŠ³£Ź¹ÓƵÄŌĮĻŹĒĢ¼ĖįĒāÄĘŗĶĮņĖįĀĮ£»
¢ŻĆ÷·ÆŌŚČÜŅŗÖŠĖ®½āÉś³ÉĒāŃõ»ÆĀĮ½ŗĢ壬Äܾ»Ė®£»
¢ŽĀČ»ÆĢśĖ®½ā³ŹĖįŠŌ£¬æÉŹ¹Ģ¼ĖįøĘČܽā£®
½ā“š ½ā£ŗ¢ŁĀČ»ÆĀĮĖ®½āÉś³ÉĒāŃõ»ÆĀĮŗĶĀČ»ÆĒā£¬¼ÓČČ“Ł½ųĀČ»ÆĒā»Ó·¢£¬“Ó¶ų“Ł½ųĀČ»ÆĀĮĖ®½ā£¬½«ČÜŅŗÕōøɵƵ½ĒāŃõ»ÆĀĮ¹ĢĢ壬ĮņĖįĀĮĖ®½āÉś³ÉĒāŃõ»ÆĀĮŗĶĮņĖį£¬¼ÓČČ“Ł½ųĮņĖįĀĮĖ®½ā£¬ŅņĪŖĮņĖįƻӊ»Ó·¢ŠŌ£¬ĖłŅŌµĆµ½µÄ¹ĢĢåČŌČ»ŹĒAl2£ØSO4£©3£¬¹Ź¢Ł“ķĪó£»
¢ŚFe3+Ņ×Ė®½ā£¬Ė®½āÉś³ÉH+£¬Ė®½āµÄĄė×Ó·½³ĢŹ½ĪŖFe3++3H2O?Fe£ØOH£©3+3H+£¬ÅäÖĘČÜŅŗŹ±£¬½«FeCl3¹ĢĢåČÜÓŚ½ĻÅØŃĪĖįÖŠŅÖÖĘFeCl3Ė®½ā£¬Č»ŗóŌŁÓĆĖ®Ļ”ŹĶµ½ĖłŠčµÄÅØ¶Č£¬ĮņĖįČÜŅŗÖŠŅżČėĮņĖįøłĄė×Ó£¬¹Ź¢Ś“ķĪó£»
¢Ū·ś»Æļ§ČÜŅŗÖŠĖ®½āÉś³ÉĒā·śĖį£¬ÄÜøÆŹ“²£Į§£¬·ś»Æļ§ČÜŅŗ²»ÄÜÓĆ²£Į§ĘæŹ¢×°£¬¹Ź¢ŪÕżČ·£»
¢ÜÅŻÄĆš»šĘ÷ÖŠ³£Ź¹ÓƵÄŌĮĻŹĒĢ¼ĖįĒāÄĘŗĶĮņĖįĀĮ£¬¹Ź¢Ü“ķĪó£»
¢ŻĆ÷·ÆŌŚČÜŅŗÖŠĖ®½āÉś³ÉĒāŃõ»ÆĀĮ½ŗĢ壬ĒāŃõ»ÆĀĮ½ŗĢå¾ßÓŠĪüø½ŠŌÄܾ»Ė®£¬¹Ź¢ŻÕżČ·£»
¢ŽĀČ»ÆĢśĖ®½ā³ŹĖįŠŌ£¬æÉŹ¹Ģ¼ĖįøĘČܽā£¬·“Ó¦µÄ·½³ĢŹ½ĪŖCaCO3+2H+=Ca2++H2O+CO2”ü£¬·“Ó¦ĻūŗÄH+£¬Ź¹c£ØH+£©¼õŠ”£¬ŅżĘšĖ®½āĘ½ŗāĻņÓŅŅĘ¶Æ£¬µ¼ÖĀFe£ØOH£©3Ōö¶ą£¬ŠĪ³ÉŗģŗÖÉ«³Įµķ£¬¹Ź¢ŽÕżČ·£»
¹ŹŃ”B£®
µćĘĄ ±¾ĢāÄѶČÖŠµČ£¬ĪļÖŹµÄŠŌÖŹ¾ö¶ØĪļÖŹµÄÓĆĶ¾£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶ»ł±¾ĄķĀŪÖŖŹ¶µÄ×ŪŗĻĄķ½āŗĶŌĖÓƵÄ漲飬עŅāŃĪĄąĖ®½āµÄŌĄķŹĒ½ā“š±¾ĢāµÄ¹Ų¼ü£¬ÕĘĪÕ³£¼ū»ÆѧĪļÖŹµÄŠŌÖŹŗĶÓĆĶ¾£¬×¢Ņā¶ŌĻą¹ŲÖŖŹ¶µÄ»żĄŪ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŠčŅŖ¼ÓČČ²ÅÄÜ·¢ÉśµÄ·“Ó¦ŹĒĪüČČ·“Ó¦ | |
| B£® | »Æѧ·“Ó¦ÖŠµÄÄÜĮæ±ä»ÆÖ»±ķĻÖĪŖČČĮæ±ä»Æ | |
| C£® | µ±·“Ó¦ĪļµÄ×ÜÄÜĮæøßÓŚÉś³ÉĪļµÄ×ÜÄÜĮæŹ±£¬Ķس£·¢Éś·ÅČČ·“Ó¦ | |
| D£® | µ±·“Ó¦ĪļµÄ×ÜÄÜĮæøßÓŚÉś³ÉĪļµÄ×ÜÄÜĮæŹ±£¬Ķس£·¢ÉśĪüČČ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
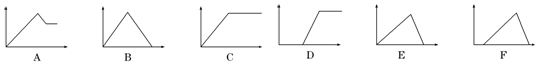
| ČÜŅŗ | ¼ÓČėµÄĪļÖŹ | ×ÖÄø“śŗÅ |
| ¢Ł±„ŗĶŹÆ»ŅĖ® | ĶعżĮæCO2 | B |
| ¢ŚAlCl3ČÜŅŗ | ĶعżĮæNH3 | C |
| ¢ŪMgCl2”¢AlCl3»ģŗĻČÜŅŗ | ÖšµĪ¼ÓNaOHČÜŅŗÖĮ¹żĮæ | A |
| ¢ÜAlCl3ČÜŅŗ | ÖšµĪ¼ÓNaOHČÜŅŗÖĮ¹żĮæ | E |
| ¢Żŗ¬ÉŁĮæHClµÄAlCl3ČÜŅŗ | ÖšµĪ¼ÓNaOHČÜŅŗÖĮ¹żĮæ | F |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ź³ĪļČÜÓŚĖ®ŗóµÄČÜŅŗÖŠpH£¼7£¬ŌņĪŖ³ÉĖįŠŌŹ³Īļ | |
| B£® | ÓÉĢ¼”¢µŖ”¢Įņ”¢Į×µČŌŖĖŲ×é³ÉµÄµ°°×ÖŹ¶ąŹĒĖįŠŌŹ³Īļ£»Źß²Ė”¢Ė®¹ū¶ąŹĒ¼īŠŌŹ³Īļ | |
| C£® | “óĆ׏Ē¼īŠŌŹ³Īļ | |
| D£® | ÄūĆŹŹĒĖįŠŌŹ³Īļ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com