
| 1000ρw |
| M |
| n |
| V |
| 1000×1.1×49% |
| 98 |
| 1.1mol |
| 0.5L |


科目:高中化学 来源: 题型:
| A、常温常压下,28 g氮气所含的原子数为2NA |
| B、1 mol氯化氢约含有6.02×1023个粒子 |
| C、22.4 L甲烷(CH4)所含的原子数为5 NA |
| D、2.4 g镁原子变成离子时,失去的电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
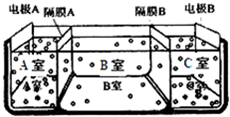 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
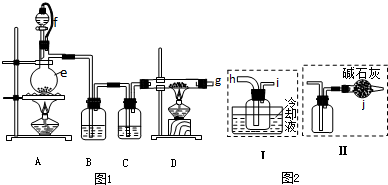
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
| 方案 | 不足之处 |
| 甲 | |
| 乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
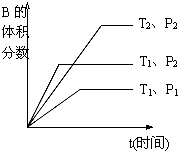 已知某可逆反应mA(g)+nB(g)?qC(g)+pD(s)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空(注:(2)、(3)、(4)题填“>”、“<”或“=”):
已知某可逆反应mA(g)+nB(g)?qC(g)+pD(s)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空(注:(2)、(3)、(4)题填“>”、“<”或“=”):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.”已知结构如图所示,则下列说法正确的是( )
2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.”已知结构如图所示,则下列说法正确的是( )| A、青蒿素与维生素C一样易溶于水工作 |
| B、所有碳原子都可能在同一平面上 |
| C、青蒿素晶体为分子晶体,其化学式为C15H22O5,具有较强氧化性 |
| D、含有酯基,在胃酸作用下能水解,其水解产物能使氯化铁溶液显紫色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com