
����Ŀ��Ħ����[(NH4)2Fe(SO4)2��6H2O]��һ����Ҫ�Ļ���ԭ�ϣ���������ȡ����Fe3O4�Ͳ��������ص���
��1��ȡһ������Ħ������Ʒ�����NaOH��Һ��Ӧ��
�ٸ�������������������õ�Ħ���εĴ���С��ʵ��ֵ����ԭ����______��
��������Fe(OH)2�����м���NaNO2��Һ���Ƶ�����Fe3O4��ͬʱ����NO���÷�Ӧ�����ӷ���ʽΪ______��
��2��Ħ���ξ���������KOH��H2C2O4��Ӧ�ɵõ����������أ�KaFeb(C2O4)c��dH2O�ݣ�����FeԪ�ػ��ϼ�Ϊ+3��
����֪25 �棬H2C2O4�ĵ��볣��Ka1=5.6��10-2��Ka2=5.4��10-5��pH=4��H2C2O4��Һ��c(C2O![]() ):c(HC2O)=______��
):c(HC2O)=______��
��Ϊ��ȷ�����������ص���ɣ�ȷ��ȡ4.910 g��Ʒ�ڵ��������¼��ȣ�������Ʒ��ʣ���������¶ȵı仯��ͼ��ʾ��
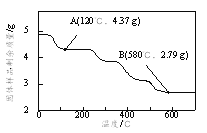
��֪��a��120��ʱ����ȫʧȥ�ᾧˮ��
b��200��~580���ֽ������CO��CO2�ָ�����״�������Ϊ1.008 L��
c��580�����ϲ�������ΪFeO��K2CO3�Ļ���
��������ʵ�����ݼ�������������е�n(Fe3+):n(C2O42-)_____________��д��������̣���
���𰸡� ������������ˮ����Һ���в��ְ���û���ݳ� 3Fe(OH)2+ 2NO��Fe3O4+2NO��+2OH��+2H2O 0.54 ����Ԫ���غ�õ��ֽ����������ΪCO��CO2��n(CO)+n(CO2)=![]() =4.5��10-2 mol��2n(C2O42-)= n(K2CO3)+ n(CO)+n(CO2)= n(K2CO3)+ 4.5��10-2 mol��n(Fe3+)��72 g��mol-1��
=4.5��10-2 mol��2n(C2O42-)= n(K2CO3)+ n(CO)+n(CO2)= n(K2CO3)+ 4.5��10-2 mol��n(Fe3+)��72 g��mol-1��![]() n(K+)��138 g��mol-1=2.79 g�� 3n(Fe3+)+ n(K+)=2��[
n(K+)��138 g��mol-1=2.79 g�� 3n(Fe3+)+ n(K+)=2��[![]() n(K+)+4.5��10-2 mol]��
n(K+)+4.5��10-2 mol]��![]() ����ã�n(Fe3+)=1��10-2 mol n(K+)= 3��10-2 mol��n(C2O42-)=3��10-2 mol��n(Fe3+):n(C2O42-)=1��10-2 mol: 3��10-2 mol=1:3
����ã�n(Fe3+)=1��10-2 mol n(K+)= 3��10-2 mol��n(C2O42-)=3��10-2 mol��n(Fe3+):n(C2O42-)=1��10-2 mol: 3��10-2 mol=1:3
��������(1)��Ħ����[(NH4)2Fe(SO4)2��6H2O]���������Ʒ�Ӧ���ɰ�����������������ˮ����Һ���в��ְ���û���ݳ�����˸�������������������õ�Ħ���εĴ���С��ʵ��ֵ���ʴ�Ϊ��������������ˮ����Һ���в��ְ���û���ݳ���
��Fe(OH)2�����м���NaNO2��Һ���Ƶ�����Fe3O4��ͬʱ����NO����Ӧ�����ӷ���ʽΪ3Fe(OH)2+ 2NO2-��Fe3O4+2NO��+2OH��+2H2O���ʴ�Ϊ��3Fe(OH)2+ 2NO2-��Fe3O4+2NO��+2OH��+2H2O��
(2)����֪25 ����H2C2O4�ĵ��볣��Ka1=5.6��10-2��Ka2=5.4��10-5��pH=4��H2C2O4��Һ��![]() =
=![]() =
=![]() =
=![]() =0.54���ʴ�Ϊ��0.54��
=0.54���ʴ�Ϊ��0.54��
�ڸ���Ԫ���غ�õ��ֽ����������ΪCO��CO2��n(CO)+n(CO2)= ![]() =4.5��10-2 mol��2n(C2O42-)= n(K2CO3)+ n(CO)+n(CO2)= n(K2CO3)+ 4.5��10-2 mol��n(Fe3+)��72 g��mol-1��
=4.5��10-2 mol��2n(C2O42-)= n(K2CO3)+ n(CO)+n(CO2)= n(K2CO3)+ 4.5��10-2 mol��n(Fe3+)��72 g��mol-1��![]() n(K+)��138 g��mol-1=2.79 g�� 3n(Fe3+)+ n(K+)=2��[
n(K+)��138 g��mol-1=2.79 g�� 3n(Fe3+)+ n(K+)=2��[![]() n(K+)+4.5��10-2 mol]��
n(K+)+4.5��10-2 mol]��![]() ����ã�n(Fe3+)=1��10-2 mol��n(K+)= 3��10-2 mol��n(C2O42-)=3��10-2 mol��n(Fe3+):n(C2O42-)=1��10-2 mol: 3��10-2 mol=1:3���ʴ�Ϊ��1:3��
����ã�n(Fe3+)=1��10-2 mol��n(K+)= 3��10-2 mol��n(C2O42-)=3��10-2 mol��n(Fe3+):n(C2O42-)=1��10-2 mol: 3��10-2 mol=1:3���ʴ�Ϊ��1:3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������(![]() )�ķ�ӦΪ��2CH2=CH2(g)+O2(g)
)�ķ�ӦΪ��2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) ��H=-106kJ/mol���䷴Ӧ�������£�
(g) ��H=-106kJ/mol���䷴Ӧ�������£�
��Ag+O2��AgO2 ��
��CH2=CH2+AgO2��![]() + AgO ��
+ AgO ��
��CH2=CH2+6AgO��2CO2+2H2O+6Ag ��
�����йظ÷�Ӧ��˵����ȷ����
A. ��Ӧ�Ļ�ܵ���106 kJ/mol
B. �÷�Ӧ��ԭ��������Ϊ100%
C. AgO2Ҳ�Ǹ÷�Ӧ�Ĵ���
D. ������ϩ��Ũ��ֻ������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪���з�Ӧ���ʱ�
��CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ��H1=-870.3kJ/mol
��C(s)+O2(g) =CO2(g) ��H2=-393.5kJ/mol
��2H2(g)+O2(g) =2H2O(l) ��H3=-285.8kJ/mol
�Լ��㷴Ӧ2C(s)+2H2(g)+O2(g) =CH3COOH(l)���ʱ䦤H=_____________kJ/mol��
��2��ʵ���ã�5gҺ̬�״�(CH3OH)�������г��ȼ�����ɶ�����̼�����Һ̬ˮʱ�ͷų�113��5kJ����������д���״�ȼ�յ��Ȼ�ѧ����ʽ:_________________________��
��3������ƽ���������̬������N2H4��Ϊȼ�ϡ�Һ̬��������Ϊ��ȼ�����������ṩ����Ӧ���������ɵ�����ɲ������ѭ������õ���Ӧ��������1molˮ��������ʱ�ų�161kJ����������д����Ӧ�����е��Ȼ�ѧ����ʽ��___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ����ѧ��ѧ�г�������Ҫ��һ�෴Ӧ���ش��������⣺
(1)���н������ʲμӵĻ�ѧ��Ӧ����������ԭ��Ӧ�����ǽ���ʧ���ӡ�
����ͬ�������Ʒֱ���������Ӧ��ȫ�����������ƺ�ȫ�����ɹ����������������ת�Ƶĵ�����Ŀ֮����________��
�ڷֱ�ȡW���ơ������������������ᷴӦ��ʧȥ���ӵ����ʵ���֮����________���۷ֱ�ȡ��0.1mol H2SO4��ϡ����ͺ�0.1mol NaOH������������Һ����֧�Թ��У��ֱ�������������۳�ַ�Ӧ���������� (ͬ��ͬѹ��)�����֮����________��
(2)ij������ԭ��Ӧ�ķ�Ӧ��������ﹲ�������ʣ�O2��H2CrO4��Cr(OH)3��H2O��H2O2��
��֪�÷�Ӧ��H2O2ת��Ϊ������
�ٸ÷�Ӧ�еĻ�ԭ����____________��
�������ѧ����ʽ��Cr(OH)3��H2O2�����ʵ���֮��Ϊ2:3��д���÷�Ӧ�Ļ�ѧ����ʽ�����������ת�Ƶķ������Ŀ_________________��
�������Ӧ��ת����3a mol���ӣ�������������ڱ�״�������Ϊ______L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ��Ӧ����
A. AgNO3��NaCl===AgCl����NaNO3 B. 3CO��Fe2O3![]() 2Fe��3CO2
2Fe��3CO2
C. 2F2��2H2O===4HF��O2 D. MgCl2(����) ![]() Mg��Cl2��
Mg��Cl2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijһ��Ӧ��ϵ�з�Ӧ��������ﹲ�������ʣ�O2��H2CrO4��Cr(OH)3��H2O��H2O2��
��֪�÷�Ӧ��H2O2ֻ�������¹��̣�H2O2��O2��
��1���÷�Ӧ�еĻ�ԭ����____��
��2���÷�Ӧ��,������ԭ��Ӧ�Ĺ�����_____��_____��
��3��д���÷�Ӧ�Ļ�ѧ����ʽ,���õ����ű������ת�Ƶķ������Ŀ_____________________��
��4���練Ӧת����0.4mol����,������������ڱ�״�������Ϊ____L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������[(C6H11O7)2Fe2H2O]����Ҫ�Ŀ��������Ӽ�����������Ч���������κá�һ�ֹ�ҵ���Ʊ��������������Ĺ����������£�
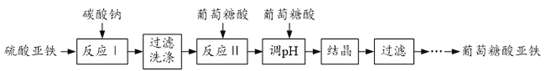
��1����Ӧ���Ļ�ѧ����ʽΪ______��
��2����̼����������ʱ���ڱ��汣��ˮ���ԭ����______��
�ڼ���FeCO3�Ѿ�ϴ�Ӹɾ��IJ���Ϊ______��
��3����Ӧ��������������������ҺpH��5.8����ԭ����______��
��4����������������Һ�ᾧ��ϴ��ʱ��������Ҵ�����Ŀ�ķֱ���______��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л���ѧ������
(1) �����еĹ��������л������������������ء�
�����л���������![]() ��Ϊͬϵ�����____(����ĸ)��
��Ϊͬϵ�����____(����ĸ)��
a. ![]() b.
b. ![]() c.
c. ![]()
�����л�������,��������ʹ���Ը��������Һ��ɫ����____(����ĸ)��
a. CH3CH3 b. HC��CH c. CH3COOH
�����л�������,�ܷ���������Ӧ����____(����ĸ)��
a. CH3CH2Cl b. CH3CHO c. CH3CH2OH
(2) ������X(![]() )��һ�ֺϳ�Һ�����ϵĻ���ԭ�ϡ�
)��һ�ֺϳ�Һ�����ϵĻ���ԭ�ϡ�
��1 mol X��һ���������������____mol H2�����ӳɷ�Ӧ��
��X������������ˮ�������![]() ��________(�ýṹ��ʽ��ʾ)��
��________(�ýṹ��ʽ��ʾ)��
��![]() �����������____��̼ԭ�ӹ�ƽ�档
�����������____��̼ԭ�ӹ�ƽ�档
(3) ������D��һ��ҽҩ�м���,��ͨ�����з����ϳɡ�
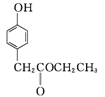
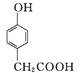 A
A![]()
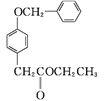
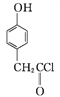 B����
B����![]()
 C������ ����
C������ ����![]()
 D
D
��A��B�ķ�Ӧ����Ϊ____��
��D�����������____��____(������)��
��C��D�ķ�Ӧ����HCl����,��M�Ľṹ��ʽΪ_______��
��E��A��һ��ͬ���칹��,E���ӵĺ˴Ź���������4�����շ�,�ܷ���������Ӧ,����FeCl3��Һ������ɫ��Ӧ��E�Ľṹ��ʽΪ___________(��дһ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����Ҵ�Ϊԭ�Ͼ�һϵ�з�Ӧ���Եõ�4�ǻ���������㶹��3���ᣬ���ߵĺϳ�·������(���ֲ��P����δ�г�)��
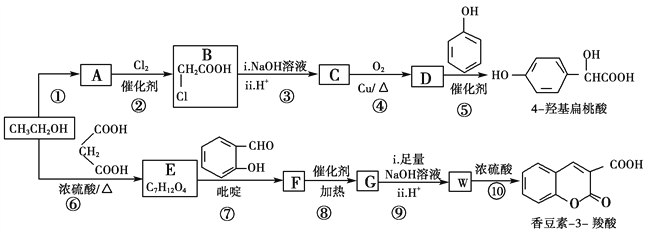
��֪��
��.RCOOR�䣫R��OH![]() RCOOR�士R��OH
RCOOR�士R��OH
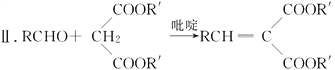
(R��R�䣬R����ʾ��ԭ�ӡ������)
�ش��������⣺
��1����Ӧ������ȡ����Ӧ����A�й����ŵ�������________
��2��  ��������________����Ӧ�ݵķ�Ӧ����Ϊ________��
��������________����Ӧ�ݵķ�Ӧ����Ϊ________��
��3����Ӧ�Ļ�ѧ����ʽ��________________________________________��
��4����֪G�����к���2����Ԫ���������й�˵����ȷ����________(����)��
a���˴Ź����ǿɲ��E��5�����͵���ԭ��
b�������ǿɼ��F������ʺɱȵ�ֵΪ236
c�� G�����е�̼ԭ�Ӿ����Թ���
d��������W�ܷ����Ӿ۷�Ӧ�õ����߷��ӻ�����
��5��ij���㻯����Q��4�ǻ��������ͬ���칹�壬���������������ٱ�����ֻ��3��ȡ���������ܷ���ˮ�ⷴӦ��������Ӧ����1 mol Q���������3 mol NaOH��Q����________��(���������칹)
��6����ϸ�۲����Ҵ��ϳ��㶹��-3-����Ĺ��̣���������Ϣ�����Ҵ������������ʵ����ı�Ϊ_______ʱ��ֻ��3��������ɺϳ�·�ߡ���д���ϳ�·��_______________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com