
(1)同温同压下,同体积的CO2和CO,它们的质量之比为 ,密度之比为 。
(2)在50 mL 1 mol·L-1 FeCl3溶液中,加入100 mL NaOH溶液恰好完全反应,则该NaOH溶液的浓度为 。
(3)标准状况下的HCl气体4.48L溶于水形成100mL溶液,所得盐酸的物质的量浓度为_____________;
将此溶液与足量的铁屑充分反应,生成的H2在标准状况下的体积为________________。
科目:高中化学 来源:2015-2016学年广东省宝安第一外国语学校高一上期中考试化学试卷(解析版) 题型:选择题
下列溶液中,与100 mL 0.5 mol/L NaCl溶液所含的Cl—的物质的量浓度相同的是( )
A.200mL0.25mol/LCaCl2溶液 B.200mL0.25mol/LHCl溶液
C.50mL1mol/LNaCl溶液 D.100mL0.5mol/LMgCl2溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上学期12月月考化学试卷(解析版) 题型:计算题
在100ml 1mol/L的AlCl3溶液中滴加的1mol/L NaOH溶液可得到3.9沉淀,则消耗的NaOH溶液的体积是多少?
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上学期12月月考化学试卷(解析版) 题型:选择题
下列各组离子中,能在溶液中大量共存的是( )
A、Na+、Mg2+、Cl-、OH- B、H+、Ca2+、CO32-、NO3-
C、Cu2+、K+、SO42-、NO3- D、Na+、HCO3-、OH-、Ca2+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一上学期12月月考化学试卷(解析版) 题型:选择题
溶液中有0.2mol XO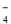 ,加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4,则还原产物中X的化合价
,加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4,则还原产物中X的化合价
为( )
A.+4 B.+3 C.+1 D.0
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期第三次月考化学试卷(解析版) 题型:填空题
分析下列溶液蒸干后得到的固体是什么?写出化学式:
(1)Na2CO3溶液蒸干得到的固体物质是 ,
(2)(NH4)2SO4溶液蒸干得到的固体物质是 ,
(3)Ba(HCO3)2溶液蒸干得到的固体物质是 ,
(4)Na2SO3 溶液蒸干得到的固体物质是 ,
(5)Mg(HCO3)2溶液蒸干得到的固体物质是 。
(6)Fe2(SO4)3溶液蒸干得到的固体物质是 。
查看答案和解析>>
科目:高中化学 来源:2016届广东省七校联合体高三上学期第二次联考理综化学试卷(解析版) 题型:填空题
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
(1)二价铜离子的电子排布式为 。已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释 。
(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:
(4)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为___________,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是 。
(5)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3在BF3·NH3中B原子的杂化方式为 ,B与N之间形成配位键,氮原子提供 。
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为 。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3。(只要求列算式)。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省沈阳市四校协作体高三上学期期中联考化学试卷(解析版) 题型:选择题
下列有关图示分析正确的是
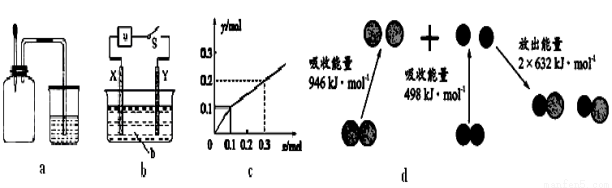
A.如图a所示,集气瓶内充满NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶
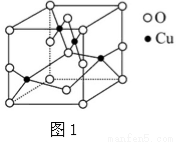
B.如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a
C.Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+
D.图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g) ΔH=-180 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com