
 ��֪ij��ӦA��g��+B��g��?C��g��+D��g������Ӧ�����е������仯��ͼ��ʾ���ش��������⣮
��֪ij��ӦA��g��+B��g��?C��g��+D��g������Ӧ�����е������仯��ͼ��ʾ���ش��������⣮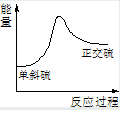
���� ��1��ͼ���з�����֪��Ӧ������������������������ӦΪ���ȷ�Ӧ����Ӧ�ʱ����0��
��2����������ܽ��ͷ�Ӧ�Ļ�ܣ��������ı䷴Ӧ����������������������֮���Ӧ�Ȳ��䣻
��3��A��������仯Ϊ������Ҫ�ų�������
B�������Ȼ�ѧ����ʽ��˹���ɼ��������
C��������������Խ��Խ���ȶ���
D����б��ת��Ϊ�������Dz�ͬ���ʵ�ת�����������ǻ�ѧ��Ӧ��
��� �⣺�⣺��1����ͼ���֪�÷�Ӧ��һ���������ߵķ�Ӧ�������������ȷ�Ӧ����H=��Ӧ����ܼ���-��������ܼ��ܣ����ԡ�H=E1-E2����ͼ���֪��֪�÷�Ӧ��һ���������ߵķ�Ӧ������1mol����A��1mol����B���е���������1mol����C��1mol����D���е��������ͣ�
�ʴ�Ϊ�����ȣ� E1-E2��һ���ͣ�
��2����������ı��˷�Ӧ��;�������ͷ�Ӧ����Ļ�ܣ�����E1��E2�ı仯�Ǽ�С���������ı䷴Ӧ����������������������֮���Ӧ�Ȳ��䣬����E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ����Ӱ�죻
�ʴ�Ϊ����С����С�����䣻
��3��A��������仯Ϊ������Ҫ�ų�������S����б��+O2��g���TSO2��g����H=-297.16kJ/mol������S��g��+O2��g����SO2��g����H����H��-297.16 kJ����A����
B����S�����+O2��g����SO2��g��+297.16kJ��
��S��������+O2��g����SO2��g��+296.83kJ
���ݸ�˹���ɢ�-�ڵõ�S����б��=S��������+0.33KJ����б����������������B����
C����б����������������б���ȶ���С��������C��ȷ��
D��ͬ��������֮���ת��Ϊ��ѧ��Ӧ�����ڻ�ѧ�仯����D����
�ʴ�Ϊ��C��
���� ���⿼�鷴Ӧ�ȵ��жϣ���H�ļ����Լ���˹���ɵ�Ӧ�ã���Ŀ�Ѷ��еȣ�ע������Ի�ܺͷ�Ӧ�ȵ�Ӱ�죮


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ۻ�������һ��û�����Ӽ� | |
| B�� | ������һ��û�����Ӽ���һ���й��ۼ� | |
| C�� | ���ۼ�ͨ��ԭ��֮���ʧ�����γ� | |
| D�� | �ǽ���Ԫ����ɵĻ������в����������Ӽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʹ��ˮ��ɫ����Ϊ������ˮ�����˻�ѧ��Ӧ | |
| B�� | ���ӵ�ı���Һ�з�����⣬ͨ��������ȡ�� | |
| C�� | ���Ͳ�����ˮ���ܶȱ�ˮ������Ȼ�̼������ɫҺ�壬���Թܺ�ˮ�Ϳ����������� | |
| D�� | ��Ϊ��ͨ������ɫҺ�壬������0��Ļ����п���ֱ�ӽ������Լ�ƿ�����Թ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1L����Һ�к�KNO3101g | |
| B�� | 100 mL����Һ�к�KNO3 0.01mol | |
| C�� | ��1L����Һ��ȡ��500 mL��ʣ����Һ��Ũ��Ϊ0.05 mol/L | |
| D�� | 1Lˮ���ܽ�0.1 mol KNO3���������0.1 mol/L KNO3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
| �������� | ��K+�� Cu2+�� Fe3+�� Al3+�� Fe2+ |
| �������� | ���� Cl-�� CO32-��NO3- SO42-�� SiO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
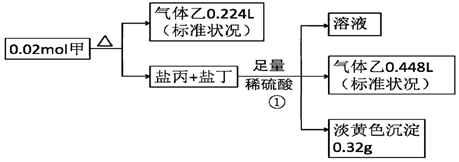
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ij��ɫ�����ĩ��Ʒ���ܺ���Fe2O3��Cu2O�е�һ�ֻ����֣�ij��ѧ��ȤС�������ɽ���̽����������пո�
ij��ɫ�����ĩ��Ʒ���ܺ���Fe2O3��Cu2O�е�һ�ֻ����֣�ij��ѧ��ȤС�������ɽ���̽����������пո��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCO3-+H2O?CO32-+H3O+ | B�� | HCO3-+OH-?CO32-+H2O | ||
| C�� | HCO3-+H2O?H2CO3+OH- | D�� | S2-+2H2O?H2S+2OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
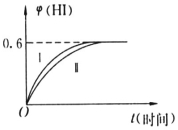 ��1molI2��g����2molH2��g������ij2L�ܱ������У���һ���¶��·�����Ӧ��I2��g��+H2��g��?2HI��g����H��0������10minʱ�ﵽƽ�⣮HI����������գ�HI����ʱ��仯��ͼ��ʾ���ߣ���
��1molI2��g����2molH2��g������ij2L�ܱ������У���һ���¶��·�����Ӧ��I2��g��+H2��g��?2HI��g����H��0������10minʱ�ﵽƽ�⣮HI����������գ�HI����ʱ��仯��ͼ��ʾ���ߣ����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com