甲烷可制成合成气(CO、H
2),再制成甲醇,代替日益供应紧张的燃油.
已知:①CH
4(g)+H
2O (g)=CO (g)+3H
2(g)△H
1=+206.2kJ?mol
-1②CH
4(g)+
O
2(g)=CO(g)+2H
2(g)△H
2=-35.4kJ?mol
-1③CH
4(g)+2H
2O (g)=CO
2(g)+4H
2(g)△H
3=+165.0kJ?mol
-1(1)CH
4(g)与CO
2(g)反应生成CO(g)和H
2(g)的热化学方程式为
.
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为
(填序号),其原因是
.
(3)合成气中的H
2可用于生产NH
3,在进入合成塔前常用Cu(NH
3)
2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH
3)
2Ac+CO+NH
3?[Cu(NH
3)
3]Ac?CO△H<0
Cu(NH
3)
2Ac溶液吸收CO的适宜生产条件应是
.
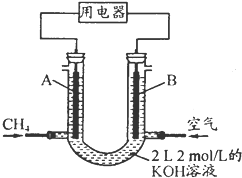
(4)将CH
4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①O<V≤44.8L时,电池总反应方程式为
;
②44.8L<V≤89.6L时,负极电极反应为
;
③V=67.2L时,溶液中离子浓度大小关系为
.

 甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.
甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案