
| A. | 甲认为上述发现绝对不可能,因为H3分子违背了共价键理论 | |
| B. | 丁认为如果上述的发现存在,则证明传统的价键理论并不完善 | |
| C. | 丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H3+ | |
| D. | 乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体 |
分析 A.理论具有一定的时代性和局限性;
B.H3分子的存在,利用传统的价键理论不能解释;
C.分子与离子是不同的微粒;
D.同位素的种类与同素异形体的种类无关.
解答 解:A.因理论具有一定的时代性和局限性,宇宙中发现H3分子,则存在该分子,故A错误;
B.H3分子的存在,利用传统的价键理论不能解释,即传统的价键理论有一定的局限性有待继续发展,故B正确;
C.分子与离子是不同的微粒,所以H3分子不能写出H3+,故C错误;
D.同位素的种类与同素异形体的种类无关,则可能还有氢单质,也可能没有,故D错误.
故选B.
点评 本题考查化学键,题目难度较大,注意理论的时代性和局限性是解答本题的关键,注意宇宙中发现H3分子,即存在该物质来解答.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
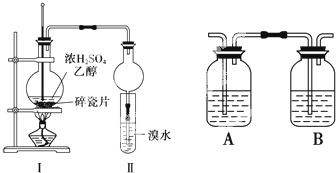 某化学兴趣小组用如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.
某化学兴趣小组用如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.5mol/L | C. | 4mol/L | D. | 1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键 | |
| B. | 共价化合物中可能含有离子键 | |
| C. | 离子化合物中只含离子键 | |
| D. | 只含共价键的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与0.1mol/LNaOH溶液反应:H+(aq)+OH-1(aq)═H2O(l)△H=-57.3kJ•mol-1 | |
| B. | 在101KPa下氢气的标准燃烧热△H=-285.5kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ•mol-1 | |
| C. | 已知2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1,则可知C的标准燃烧热为110.5kJ•mol-1 | |
| D. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量,则Fe(s)+S(g)═FeS(s)△H=-95.6kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com