
| A. | 6:11 | B. | 5:6 | C. | 11:6 | D. | 6:5 |
分析 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中得电子化合价降低的P原子被还原,失电子化合价升高的P原子被氧化.
解答 解:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,得电子化合价降低的P原子被还原,失电子化合价升高的P原子被氧化;如果有11molP参加氧化还原反应,有5molP化合价降低被还原生成5molCu3P,有6molP化合价升高被氧化生成6molH3PO4,所以被氧化的P原子与被还原的P原子个数比是6:5.
故选D.
点评 本题考查氧化还原反应,明确元素的化合价降低表现氧化性,化合价升高表现还原性,能正确判断磷元素的化合价变化是解答本题的关键,侧重于学生的分析能力和计算能力的考查,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
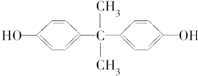 ).聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍.双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病.请回答下列问题:
).聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍.双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病.请回答下列问题: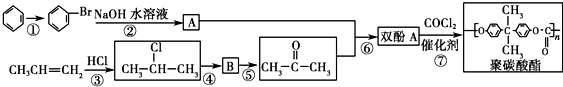
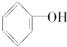 .
.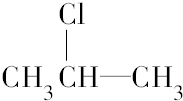 按系统命名法的名称为2-氯丙烷.
按系统命名法的名称为2-氯丙烷.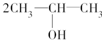 +O2$→_{△}^{催化剂}$
+O2$→_{△}^{催化剂}$ +2H2O.
+2H2O.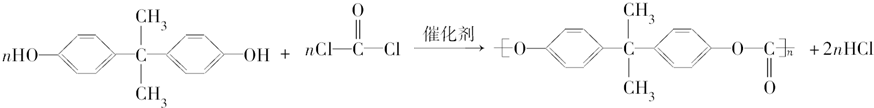 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
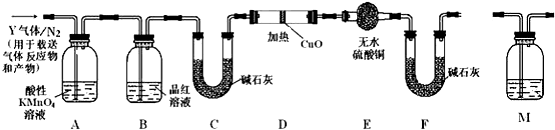
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4+O2═N2+2H2O△H=-534.4 kJ•mol-1 | |
| B. | N2H4+O2═N2+2H2O△H=-1 068.8 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.4 kJ•mol-1 | |
| D. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(g)△H=+267.2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 48gO3含有的氧原子数目为NA | |
| B. | 常温常压下,22.4L Cl2含有的分子数目为NA | |
| C. | 1molAl与足量氢氧化钠溶液完全反应时失去的电子数目为3NA | |
| D. | 1mol•L-1K2CO3溶液中含有的钾离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
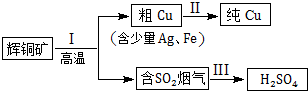
| 所含离子 | Na+ | HCO3- | CO32- | SO32- | HSO3- |
| 浓度mol/L | 0.005 | 0.01 | 0.05 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO-3+Ba2++2OH-═BaCO3↓+2H2O+CO32- | |
| B. | Fe(NO3)3溶液中加入过量的HI溶液;2Fe3++2I-═2Fe2++I2 | |
| C. | Na2S203溶液中加入稀硫酸:S2O32-+2H+═SO2+S↓+H2O | |
| D. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+═Cl2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com