
| 容器 | A | B |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 反应能量变化 | 放出29.4KJ | 吸收aKJ |
分析 Ⅰ、A.电离出来的氢离子浓度越大,与钠反应速率越大;
B.越难电离,则离子越易与氢离子结合;
C.Km=c(CH3O-)×c(CH3OH2+),只受温度的影响;
D.根据电荷守恒分析;
Ⅱ、根据盖斯定律,(①-②-③×4)÷2可得CH3OH(l)+O2(g)=CO(g)+2H2O(l),△H;
Ⅲ、(1)在酸性条件下,甲醇失去电子后与水反应生成二氧化碳和氢离子;
(2)电池通入甲醇的为负极,乙中石墨电极为阳极、铁电极为阴极,阳极上先Cl-在阳极放电生成氯气,后OH-放点O2,阴极上先Cu2+放电生成Cu,后H+放电生成H2,写出电极反应式,依据转移电子的物质的量相同进行计算;
Ⅳ、方法一:(1)A.n(CO):n(H2):n(CH3OH)=1:2:1,不能说明浓度不再变化;
B.恒温恒容,气体总压强与气体总的物质的量成正比;
C.H2的消耗速率与CH3OH的生成速率之比为2:1,均表示正反应速率;
D.根据$ρ=\frac{m}{V}$分析气体的密度是否为变量;
(2)根据外界条件对化学平衡移动的影响进行判断,注意条件的改变大于平衡移动的改变;
方法二:(1)先根据反应中能量变化求出参加反应的H2的物质的量,然后再根据v=$\frac{△c}{△t}$求出H2的平均反应速率;
(2)恒温恒容下,容器A与容器B为等效平衡,平衡时对应组分的物质的量、浓度相等,二者起始物质的量等于各物质的化学计量数,放出热量与吸收热量之和等于反应热数值;B容器中反应达到平衡时,CH3OH的转化率与A容器中反应达到平衡时CH3OH的产率之和等于1;
(3)平衡后保持温度和体积不变,将A、B中的物质合并在A容器中,压强增大,平衡正向移动.
解答 解:Ⅰ、A.电离出来的氢离子浓度越大,与钠反应速率越大,水的电离程度大于甲醇,则水中氢离子浓度大,所以钠与水的反应比钠与甲醇反应更剧烈,故A错误;
B.越难电离,则离子越易与氢离子结合,甲醇难电离,则结合H+的能力CH3O->OH-,故B正确;
C.Km为甲醇中离子浓度的乘积,只受温度的影响,温度不变,Km不变,故C正确;
D.所得到溶液中存在电荷守恒,即c(Na+)+c(CH3OH2+)=c(CH3O-),故D正确;
故答案为:A;
Ⅱ、①2CH3OH+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6KJ/mol;
②CO(g)+O2(g)═2CO2(g)△H=-566.0KJ/mol;
③H2O(g)═H2O(l)△H=-44.0KJ/mol;
根据盖斯定律,将已知反应(①-②+③×4)÷2得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),△H=$\frac{1}{2}$[(-1275.6kJ/mol)-(-566.0kJ/mol)+(-44.0kJ/mol)×4]=-442.8 kJ•mol-1,
故答案为:442.8;
Ⅲ、(1)在酸性条件下,甲醇失去电子后与水反应生成二氧化碳和氢离子,电极反应式为CH3OH-6e-+H2O=CO2↑+6H+,
故答案为:CH3OH-6e-+H2O=CO2↑+6H+;
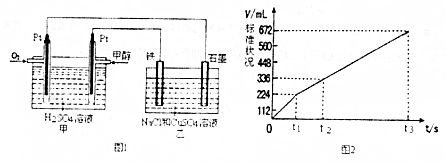
(2)阴极上先Cu2+放电生成Cu,后H+放电生成H2,阳极上先Cl-在阳极放电生成氯气,后OH-放点O2,因此图2表示乙中阳极产生气体的体积与电解时间的关系;
t1前电极反应式为:阳极2Cl--2e-=Cl2↑,产生224mlCl2时,失去电子的物质的量为$\frac{224×1{0}^{-3}L}{22.4L/mol}$×2=2×10-2 mol,
t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,产生112mlO2时,失去电子的物质的量为$\frac{112×1{0}^{-3}L}{22.4L/mol}$×4=2×10-2 mol,
总共失去4×10-2 mol的电子,
正极:O2+2H2O+4e-=4OH-,得到4×10-2 mol的电子时,消耗氧气的物质的量为10-2 mol,标况下的体积为224ml,
故答案为:阳;224;
Ⅳ、方法一:(1)A.n(CO):n(H2):n(CH3OH)=1:2:1,不能说明浓度不再变化,故A错误;
B.恒温恒容,气体总压强与气体总的物质的量成正比,该反应中气体不是等物质的量的反应,所以气体总压强不变,说明达到化学平衡状态,故B正确;
C.H2的消耗速率与CH3OH的生成速率之比为2:1,均表示正反应速率,不能说明正、逆反应速率相等,故C错误;
D.根据$ρ=\frac{m}{V}$,气体的总质量m不变,为恒容容器V不变,所以气体的密度是定值,因此不能说明达到化学平衡状态,故D错误;
故答案为:B;
(2)A.升高温度,化学平衡逆向移动,$\frac{n(C{H}_{3}OH)}{c(CO)}$减小,故A错误;
B.将CH3OH从容器中分离出去一部分,化学平衡正向移动,但条件的改变大于平衡移动的改变,所以$\frac{n(C{H}_{3}OH)}{c(CO)}$减小,故B错误;
C.体积不变,充入氢气,化学平衡正向移动,n(CH3OH)增大,c(CO)减小,所以$\frac{n(C{H}_{3}OH)}{c(CO)}$增大,故C正确;
D.选用更有效的催化剂,化学平衡不移动,所以$\frac{n(C{H}_{3}OH)}{c(CO)}$不变,故D错误;
E.体积不变,充入氦气,使体系压强增大,并没有影响各组分的浓度,化学平衡不移动,所以$\frac{n(C{H}_{3}OH)}{c(CO)}$不变,故E错误;
故答案为:C;
方法二:(1)3molH2完全反应放出49.0kJ热量,当放出29.4kJ热量时,则参加反应的n(H2)=3mol×$\frac{29.4}{49.0}$=1.8mol,
v(H2)=$\frac{1.8mol}{1L×10s}$=0.18 mol/(L•s),
故答案为:0.18 mol/(L•s);
(2)恒温恒容下,容器A与容器B为等效平衡,平衡时对应组分的物质的量、浓度相等,二者起始物质的量等于各物质的化学计量数,放出热量与吸收热量之和等于反应热数值,则吸收的热量=反应热-放出的热量=49.0kJ-29.4kJ=19.6kJ;
A容器中反应达到平衡时CH3OH的产率为$\frac{29.4}{49.0}$×100%=60%,所以B容器中反应达到平衡时,CH3OH的转化率为1-60%=40%,
故答案为:19.6;40;
(3)平衡后保持温度和体积不变,将A、B中的物质合并在A容器中,假设平衡不发生移动,此时CH3OH的物质的量是1.2mol,但是压强增大,平衡正向移动,所以导致CH3OH的物质的量大于1.2mol,
故答案为:大于.
点评 本题考查了弱电解质的电离、化学反应速率的计算和化学平衡原理的应用、电化学原理的应用等知识点,为高频考点,难度较大,学习中要加强化学原理的理解和计算能力的培养.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用规格为10 mL的量筒量取6mL的液体 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Cl2+6FeI2═4FeI3+2FeCl3 | B. | 3Cl2+2FeI2═2FeCl3+2I2 | ||
| C. | Co2O3+6HCl═2CoCl2+Cl2↑+3H2O | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用排水法收集二氧化氮气体 | |
| B. | 浓硝酸存放于棕色广口试剂瓶中 | |
| C. | 配制氯化亚铁溶液时,将氯化亚铁固体溶解在蒸馏水中加少量盐酸即可 | |
| D. | 蒸馏时应先向冷凝管中通入冷凝水再加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,224 mL水中含有的电子数为0.1NA | |
| B. | 44 g由N2O和CO2组成的混合气体中含有的原子数为3NA | |
| C. | 将20 mL 0.5 mol•L-1 FeCl3溶液煮沸,所得胶粒数目为0.01NA | |
| D. | 在反应:KClO3+6HCl═KCl+3Cl2+3H2O中,每生成3mol Cl2,转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 雾霾天气严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染.
雾霾天气严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染.| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝及其合金是生活中广泛使用的材料,通常用电解氯化铝的方法制取 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 偏二甲肼[NH2N(CH3)2]是一种液体燃料,它的一种同分异构体可以是氨基酸 | |
| D. | 邻苯二甲酸二辛酯常用作增塑剂,对人体无害,可用作食品添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com