
| A. | D为气体 | B. | B的转化率为80% | ||
| C. | 5min时,c(A)=1.5mol•L-1 | D. | 反应开始前A的物质的量为2mol |
分析 5min时,测得密闭容器内气体压强减小,则正反应为气体物质的量减小的反应,故D为非气体;
5min内,v(A)=0.2mol•L-1•minL-1,则△n(A)=0.2mol•L-1•minL-1×5min×1L=1mol,设开始A、B的物质的量均为n,则:
2A(g)+B(g)?2C(g)+2D(?)
开始(mol):n n 0
转化(mol):1 0.5 1
5min时(mol):n-1 n-0.5 1
此时c(A):c(B)=3:4,则(n-1):(n-0.5)=3:4,解得n=2.5,据此解答.
解答 解:5min内,v(A)=0.2mol•L-1•minL-1,则△n(A)=0.2mol•L-1•minL-1×5min×1L=1mol,设开始A、B的物质的量均为n,则:
2A(g)+B(g)?2C(g)+2D(?)
开始(mol):n n 0
转化(mol):1 0.5 1
5min时(mol):n-1 n-0.5 1
此时c(A):c(B)=3:4,则(n-1):(n-0.5)=3:4,解得n=2.5,
A.5min时,测得密闭容器内气体压强减小,则正反应为气体物质的量减小的反应,故D为非气体,故A错误;
B.B的转化率为$\frac{0.5mol}{2.5mol}$×100%=20%,故B错误;
C.5min时,c(A)=$\frac{2.5mol-1mol}{1L}$=1.5mol•L-1,故C正确;
D.由上述计算可知,反应开始前A的物质的量为2.5mol,故D错误,
故选:C.
点评 本题考查化学平衡的计算,侧重分析与计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1molN2含有NA个分子 | |
| B. | 标准状况下,22.4LCH4含有约4NA个氢原子 | |
| C. | 1molK2SO4溶于足量的水中后,溶液中含有2NA个K+ | |
| D. | 1molCH4比1molH2O的分子数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 剩余固体一定有铜 | B. | 反应后的溶液呈蓝色 | ||
| C. | 剩余固体中一定有银 | D. | 反应后的溶液为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
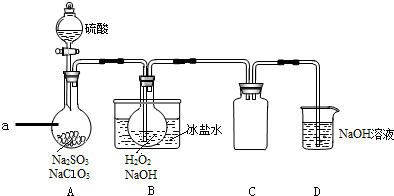
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0mol | B. | 1mol | C. | 2mol | D. | 3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,NA个CHCl3分子所占的体积约为22.4L | |
| B. | 苯分子中的所有原子都在同一个平面上 | |
| C. | 点燃甲烷必须事先进行验纯 | |
| D. | 甲烷燃烧能放出大量的热,所以是一种很好的气体燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成0.3 mol Cl2时,转移电子的物质的量为0.6 mol | |
| B. | 该反应中,生成的Cl2的摩尔质量约为70.7 g/mol | |
| C. | 被0.1 mol K37ClO3氧化的H35Cl的物质的量为0.6 mol | |
| D. | 该反应中,H35Cl发生氧化反应,KCl是还原产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com